Generel information
Anvendelsesområder
Behandling af migræneanfald med eller uden aura.
Dispenseringsform
Tabletter. 1 tablet indeholder 50 mg eller 100 mg sumatriptan (som succinat).
Doseringsforslag
Migræneanfald
- Voksne. 50-100 mg.
- Vender symptomerne tilbage, til trods for god effekt af 1. dosis, kan en yderligere dosis gives inden for de næste 24 timer, forudsat at der går mindst 2 timer mellem de 2 doser.
- Maksimal døgndosis er 300 mg.
Bemærk:
- Hvis 1. dosis ikke virker, vindes intet ved at gentage doseringen til samme anfald. I stedet kan NSAID eller paracetamol anvendes.
- Manglende erfaring vedr. oral og subkutan behandling af patienter < 18 år og > 65 år.
- Triptaner bør højst benyttes 9 dage pr. måned for at undgå medicinoverforbrugshovedpine.
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 50 mg, Parallelimport (Nordic Prime ApS) Delekærv |
| filmovertrukne tabletter 100 mg, Parallelimport (Nordic Prime ApS) Ingen kærv |
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Knusning/åbning
Kan knuses.
Administration
Synkes hele.
Tablet eller knust tablet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat leverfunktion
- Forsigtighed tilrådes ved let til moderat nedsat leverfunktion.
- Kontraindiceret ved stærkt nedsat leverfunktion.
Kontraindikationer
- Iskæmisk hjertesygdom
- Prinzmetal-angina/koronar vasospasme
- Tidligere myokardieinfarkt
- Tidligere cerebrovaskulært attak (CVA)
- Transitorisk cerebral iskæmi (TCI) i hjernen
- Ukontrolleret hypertension
- Symptomgivende perifere vaskulære lidelser
- Samtidig indgift af ergotamin, derivater af ergotamin eller andre triptaner/5-HT1-receptoragonister. Se interaktioner.
- Svær overfølsomhed for andre triptaner pga. risiko for krydsallergi
- Samtidig administration af monoaminooxidase-hæmmere (MAO-hæmmere). Sumatriptan bør ikke bruges inden for 2 uger efter seponering af behandling med MAO-hæmmere.
Forsigtighedsregler
- Patienter med epilepsi/nedsat krampetærskel
- Bør ikke gives til patienter i risikogruppen for iskæmisk hjertelidelse uden forudgående kardiovaskulær undersøgelse, herunder patienter, der ryger eller bruger nicotinsubstitution, postmenopausale kvinder, mænd over 40 år samt personer med diabetes.
- Forsigtighed ved alvorlig overfølsomhedsreaktion for antibakterielle sulfonamider, fx dapson, sulfamethizol, sulfamethoxazol og sulfasalazin, selvom risikoen for krydsallergi er beskeden.
- Diagnosen medicinfremkaldt hovedpine bør overvejes hos patienter med hyppig eller daglig hovedpine på trods af (eller på grund af) regelmæssig brug af medicin mod akut migræne.
- Kontrolleret hypertension, da forbigående øgninger i blodtrykket er observeret hos en lille gruppe patienter.
Bivirkninger
Der kan forekomme en følelse af svaghed og træthed, som sædvanligvis er forbigående og mild til moderat.
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Kvalme, Opkastning | |
| Almene symptomer og reaktioner på administrationsstedet | Smerter | Kuldefornemmelse, Tyngdefornemmelse |
| Undersøgelser | Blodtryksændringer | |
| Knogler, led, muskler og bindevæv | Myalgi | |
| Nervesystemet | Hypæstesi, Paræstesier, Svimmelhed | |
| Psykiske forstyrrelser | Døsighed | |
| Luftveje, thorax og mediastinum | Dyspnø | |
| Hud og subkutane væv | Rødme | |
| Vaskulære sygdomme | Varmefølelse | |
| Meget sjældne (< 0,01 %) | ||
| Hjerte | Angina pectoris, Arytmier, Bradykardi, Myokardieinfarkt | |
| Øjne | Dobbeltsyn, Synsforstyrrelser, Synstab | |
| Lever og galdeveje | Leverpåvirkning | |
| Undersøgelser | Ekg-forandringer | |
| Knogler, led, muskler og bindevæv | Kramper | |
| Nervesystemet | Dystoni | |
| Vaskulære sygdomme | Hypotension | |
| Ikke kendt hyppighed | ||
| Mave-tarm-kanalen | Diarré, Synkebesvær | |
| Knogler, led, muskler og bindevæv | Artralgi | |
| Psykiske forstyrrelser | Angst | |
Efter administration med næsespray er der set mild, forbigående irritation og brændende fornemmelse i næse og hals, smagsforstyrrelser samt næseblod.
Der er desuden observeret allergiske reaktioner fra hududslæt til i sjældne tilfælde anafylaktisk reaktion samt aktiveret inflammationssmerte.
Interaktioner
- På grund af risiko for vasokonstriktorisk effekt skal der gå mindst 24 timer efter indgift af ergotamin før evt. administration af triptaner. Omvendt skal der gå 6 timer efter indgift af triptan før administration af ergotamin.
- På grund af additiv effekt skal der gå 24 timer mellem indgift af sumatriptan og ergotamin, ergotderivater eller andre triptaner/5-HT1-receptoragonister.
- Behandling med MAO-hæmmere inden for 2 uger inden behandling med sumatriptan forlænger og forstærker virkningen og bivirkninger af sumatriptan.
- Samtidig brug af SSRI, SNRI eller opioider giver risiko for udvikling af serotoninsyndrom.
- Bivirkninger kan være hyppigere ved samtidig brug af triptaner og produkter indeholdende perikon.
Graviditet
Baggrund: Der er data for mange tusinde 1. trimester-eksponerede uden tegn på overhyppighed af uønsket fosterpåvirkning. Et register fandt 3 tilfælde af øsofagusatresi ud af 2.500 eksponerede, hvor den normale frekvens er ca. 1/5.000. Dette kan være tilfældigt, men såfremt der er en sammenhæng, er risikoen meget lav.
Amning
Baggrund: Efter subkutan anvendelse er den relative vægtjusterede dosis 3,5 %, og med den lave orale biotilgængelighed (15 %) må mængden, der optages systemisk hos barnet, forventes at være endnu mindre. Der er ikke beskrevet bivirkninger hos barnet.
Bloddonor
Ingen karantæne ved tapning af plasma til fraktionering.
Alkohol
Alkohol og Sumatriptan "Nordic Prime" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
- Virker vasokonstriktorisk på intrakranielle arterier og hæmmer frigørelse af peptider. Virkningen skyldes selektiv stimulation af 5-HT1B/1D-receptorerne. Ændrer ikke den cerebrale blodgennemstrømning.
- Begyndende effekt efter ca. 10 minutter (subkutant), ca. 15 minutter (intranasalt) og ca. 30 minutter (oralt).
Farmakokinetik
- Fordelingsvolumen ca. 2,4 l/kg.
- Metaboliseres i leveren til inaktive metabolitter.
- Plasmahalveringstid ca. 2 timer.
- 3-22 % udskilles uomdannet gennem nyrerne.
- Oral administration. Biotilgængelighed ca. 15 %. Maksimal plasmakoncentration efter 1-1,5 timer.
- Intranasal administration. Biotilgængelighed ca. 15 %. Maksimal plasmakoncentration efter 1-1,5 timer.
- Subkutan administration. Biotilgængeligheden ca. 96 %. Maksimal plasmakoncentration efter ca. 25 minutter.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 50 mg (Nordic Prime ApS) |
Farve
Andre
|
|
| 100 mg (Nordic Prime ApS) |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | filmovertrukne tabletter
50 mg
(Nordic Prime ApS)
Sumatriptan "Nordic Prime" |
171786 |
18 stk. (blister)
|
196,65 | 10,93 | 10,93 | |
| (B) | filmovertrukne tabletter
100 mg
(Nordic Prime ApS)
(kan dosisdisp.)
Sumatriptan "Nordic Prime" |
541952 |
6 stk. (blister)
|
604,55 | 100,76 | 50,38 |
Substitution
| filmovertrukne tabletter 50 mg |
|---|
| Imigran Sprint GSK Pharma, Sumatriptan, dispergible tabletter 50 mg |
| Sumatriptan "Accord" Accord, Sumatriptan, filmovertrukne tabletter 50 mg |
| Sumatriptan "Bluefish" Bluefish, Sumatriptan, tabletter 50 mg |
| Sumatriptan "Teva" TEVA, Sumatriptan, filmovertrukne tabletter 50 mg |
| Sumatriptan "Viatris" Viatris, Sumatriptan, filmovertrukne tabletter 50 mg |
| filmovertrukne tabletter 100 mg |
|---|
| Imigran Sprint GSK Pharma, Sumatriptan, dispergible tabletter 100 mg |
| Sumatriptan "2care4" (Parallelimport), Sumatriptan, filmovertrukne tabletter 100 mg |
| Sumatriptan "Accord" Accord, Sumatriptan, filmovertrukne tabletter 100 mg |
| Sumatriptan "Bluefish" Bluefish, Sumatriptan, tabletter 100 mg |
| Sumatriptan "Teva" TEVA, Sumatriptan, filmovertrukne tabletter 100 mg |
| Sumatriptan "Viatris" Viatris, Sumatriptan, filmovertrukne tabletter 100 mg |
Foto og identifikation
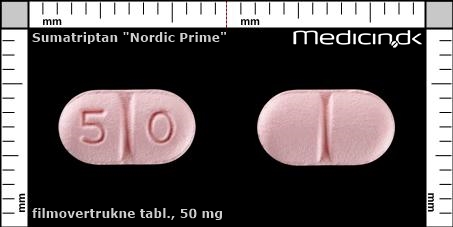
Filmovertrukne tabletter 50 mg (Nordic Prime ApS) |
| Præg: |
Intet præg
|
| Kærv: | Delekærv |
| Farve: | Lyserød |
| Mål i mm: | 5,5 x 9,6 |
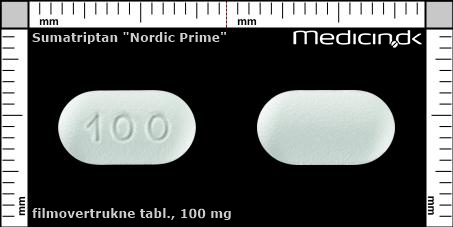
Filmovertrukne tabletter 100 mg (Nordic Prime ApS) |
| Præg: |
100
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 12,3 x 6,6 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
4252. Marchenko A, Etwel F, Olutunfese O. Pregnancy outcome following prenatal exposure to triptan medications: a meta-analysis. Headache. 2015; 55:490-501, https://www.ncbi.nlm.nih.gov/pubmed/25644494 (Lokaliseret 24. februar 2022)
4253. Ephross SA, Sinclair SM. Final results from the 16-year sumatriptan, naratriptan, and treximet pregnancy registry. Headache. 2014; 54:1158-72, https://www.ncbi.nlm.nih.gov/pubmed/24805878 (Lokaliseret 24. februar 2022)
4251. Nezvalová-Henriksen K, Spigset O, Nordeng H. Triptan safety during pregnancy: a Norwegian population registry study. Eur J Epidemiol. 2013; 28:759-69, https://www.ncbi.nlm.nih.gov/pubmed/23884894 (Lokaliseret 24. februar 2022)
3875. Nezvalová-Henriksen K, Spigset O, Nordeng H. Effects of codeine on pregnancy outcome: results from a large population-based cohort study. Eur J Clin Pharmacol. 2011; 67(12):1253-61, https://www.ncbi.nlm.nih.gov/pubmed/21656212 (Lokaliseret 24. februar 2022)
3772. UpToDate. Wolters Kluwer. , https://www.uptodate.com (Lokaliseret 24. februar 2022)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



