Generel information
Middel mod idiopatisk pulmonal fibrose (IPF).
Anvendelsesområder
- Idiopatisk pulmonal fibrose (IPF).
Præparatet bør kun anvendes, når behandlingen forestås af læger med særligt kendskab til behandling af IPF.
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 801 mg pirfenidon.
Doseringsforslag
Voksne
- Initialdosis. 267 mg 3 gange dgl. i 1 uge, derpå 534 mg 3 gange dgl. i 1 uge og herefter vedligeholdelsesdosis 801 mg 3 gange dgl.
Bemærk:
- Tabletterne tages med et glas vand.
- Tabletterne kan knuses.
- Knust tablet kan opslæmmes i vand.
- Knust tablet kan kommes på kold, blød mad.
- Tages med mad. Indtagelse sammen med mad nedsætter risikoen for bivirkninger, bl.a. kvalme og svimmelhed.
- Ved behandlingspauser af mindst 14 dages varighed bør behandlingen genoptages med det indledende titreringsregime over 2 uger.
Gastro-intestinale bivirkninger. Indtagelse i forbindelse med måltiderne mindsker risikoen for gastro-intestinale bivirkninger. Ved vedvarende symptomer kan opsplitning af dosis (fx 801 mg i løbet af måltidet eller i løbet af 1 time) eller dosisnedsættelse (midlertidig eller permanent) til minimum 534 mg 3 gange dgl. forsøges. Fortsætter symptomerne kan behandlingen pauseres i 1-2 uger.
Lysfølsomhed eller hudreaktioner. Indtagelse i forbindelse med måltiderne mindsker risikoen. Ved mild til moderat lysfølsomhedsreaktion eller hududslæt kan dosis nedsættes til 267 mg 3 gange dgl. Vedvarer symptomerne i mere end 7 dage bør behandlingen pauseres i 15 dage. Ved alvorlig lysfølsomhedsreaktion eller hududslæt seponeres behandlingen. Ved ophørte symptomer kan genopstart af behandlingen forsøges.
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 801 mg, Accord Ingen kærv |
Mad og drikke
Tages med et glas vand.
Tages med mad.
Knust tablet kan kommes på kold, blød mad.
Knusning/åbning
Kan knuses.
Administration
Knust tablet kan opslæmmes i vand.
OBS
Indtagelse sammen med mad nedsætter risikoen for kvalme og svimmelhed.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Kontraindiceret, øget bivirkningsrisiko
GFR: 0-30 ml/min.
Kontraindiceret pga. mulig ophobning af den aktive metabolit 5-carboxy-pirfenidon (eksponering øges ca. 6 gange).
Forsigtighed, øget bivirkningsrisiko
GFR: 30-50 ml/min.
Forsigtighed tilrådes pga. risiko for ophobning af den aktive metabolit 5-carboxy-pirfenidon (eksponering øges 3,5 gange).
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
- Forsigtighed ved eksisterende mild eller moderat nedsat leverfunktion (Child-Pugh A-B).
- Kontraindiceret ved stærkt nedsat leverfunktion (Child-Pugh C).
Kontraindikationer
Samtidig anvendelse af fluvoxamin (potent CYP1A2-hæmmer).
Forsigtighedsregler
Leverpåvirkning
ALAT bør måles, før behandling påbegyndes. Derefter hver måned i 6 måneder, og herefter hver 3. måned.
- Ved ALAT mellem 3-5 gange over øvre normalgrænse overvåges patienten og hvis det vurderes nødvendigt, kan dosis nedsættes eller behandlingen seponeres, indtil ALAT er inden for normalområdet.
- Ved ALAT mellem 3- 5 gange over øvre normalgrænse med samtidige symptomer på nedsat leverfunktion seponeres behandlingen permanent.
- Ved ALAT over 5 gange øvre normalgrænse seponeres behandlingen permanent.
Risiko for hyponatriæmi
Plasma-natrium bør kontrolleres jævnligt - særligt ved tegn og symptomer på hyponatriæmi som kvalme, hovedpine og svimmelhed.
Lysfølsomhed eller hudreaktioner
Pga. risiko for fotosensibilisering bør direkte sollys og UV-lys så vidt mulig undgås og ellers bør der anvendes solbeskyttelsesprodukter med høj faktor (helst faktor 50), der beskytter mod både UVA- og UVB-stråling.
Der er forekommet tilfælde af alvorlige hudreaktioner (Steven-Johnsons syndrom og toksisk epidermal nekrolyse) efter markedsføring. Ved tegn på alvorlig hudreaktion, skal behandlingen seponeres; udvikles Steven-Johnsons syndrom eller toksisk epidermal nekrolyse må behandlingen ikke genoptages.
Tobaksrygning
Pga. induktion af CYP1A2 og følgende nedsat eksponering for pirfenidon bør tobaksrygning undgås under behandlingen. Se endvidere interaktioner.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Dyspepsi, Gastro-øsofageal refluks, Kvalme, Obstipation, Opkastning | |
| Infektioner og parasitære sygdomme | Infektion i øvre luftveje | |
| Undersøgelser | Vægttab | |
| Metabolisme og ernæring | Nedsat appetit | |
| Knogler, led, muskler og bindevæv | Artralgi | |
| Nervesystemet | Svimmelhed | |
| Psykiske forstyrrelser | Søvnløshed | |
| Luftveje, thorax og mediastinum | Dyspnø | Hoste (produktiv hoste ses almindeligt) |
| Hud og subkutane væv | Hududslæt | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Agranulocytose | |
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Flatulens, Gastritis, Meteorisme, Smagsforstyrrelser |
| Almene symptomer og reaktioner på administrationsstedet | Letargi | Kraftesløshed, Træthed |
| Undersøgelser | Forhøjede levertransaminaser | |
| Knogler, led, muskler og bindevæv | Myalgi | |
| Nervesystemet | Hovedpine | |
| Psykiske forstyrrelser | Somnolens | |
| Nyrer og urinveje | Urinvejsinfektion | |
| Det reproduktive system og mammae | Brystsmerter (ikke-kardielle) | |
| Hud og subkutane væv | Erytem, Fotosensibilitet | Hudkløe, Makulopapuløst hududslæt, Solskoldning, Tør hud |
| Vaskulære sygdomme | Hedeture | |
| Ikke almindelige (0,1-1 %) | ||
| Lever og galdeveje | Leverskade | |
| Immunsystemet | Angioødem | |
| Undersøgelser | Forhøjet bilirubin (i kombination med forhøjet ALAT/ASAT) | |
| Metabolisme og ernæring | Hyponatriæmi | |
| Ikke kendt hyppighed | ||
| Immunsystemet | Anafylaktisk reaktion, Stevens-Johnsons syndrom | |
| Hud og subkutane væv | Lægemiddelreaktion med eosinofili og systemiske symptomer - DRESS, Toksisk epidermal nekrolyse (TEN) | |
Kliniske aspekter
- Hyppigste bivirkning ifm. kliniske studier var kvalme, nedsat appetit, vægttab og hududslæt, der alle sås hos over 20 %. I et studie med selvrapportering af gastro-intestinale bivirkninger forekom nedsat appetit med vægttab også hyppigt (6228).
- En række af de registrerede bivirkninger skyldes sandsynligvis grundlidelsen. Det gælder fx hoste, dyspnø, luftvejsinfektioner og brystsmerter.
- Ved kvalme kan behandles med antiemetika. Ved vægttab fokus på kostvejledning og ernæringstilskud (proteindrik).
- Fotosensitivt udslæt forekommer hos under 20 %, men kan være stærkt generende og medføre dosisreduktion eller seponering.
- Svimmelhed (opmærksomhed på evt. trafikrisiko) ses i starten af behandling og aftager typisk efter henholdsvis 6 måneders og 1 måneds behandling, mens hudbivirkningerne kan være mere vedvarende (5306).
- Indtag i forbindelse med måltider mindsker risikoen for både gastro-intestinale bivirkninger og hudreaktioner - se doseringsanbefalinger.
Interaktioner
- Fluvoxamin øger AUC for pirfenidon ca. 4 gange pga. CYP1A2-hæmning, og en lignende effekt må forventes af andre potente CYP1A2-hæmmere, fx ciprofloxacin, amiodaron og propafenon samt grapefrugtjuice. Kombinationerne bør så vidt muligt undgås. Hvis behandling med et af midlerne skønnes nødvendig, kan pirfenidon-dosis evt. nedsættes eller behandlingen pauseres. Se endvidere tabel 2 i Elimination og cytokrom P450-systemet.
- Induktorer af CYP1A2 nedsætter eksponeringen for pirfenidon. Samtidig brug af stærke CYP1A2-induktorer (fx rifampicin) og tobaksrygning bør undgås.
Graviditet
Amning
Bloddonor
Alkohol
Alkohol og Pirfenidone "Accord" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Virkningsmekanismen er ikke endeligt klarlagt, men pirfenidon virker bl.a. antifibrotisk ved at reducere dannelsen af fibroblaster og andre stoffer, som er involveret i dannelsen af fibrøst væv.
Farmakokinetik
- Metaboliseres i leveren overvejende via CYP1A2 samt i mindre omfang via CYP2C9, CYP2C19, CYP2D6 og CYP2E1.
- Terminal plasmahalveringstid 2-3 timer.
- < 1 % udskilles uomdannet gennem nyrerne.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 801 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | filmovertrukne tabletter
801 mg
Pirfenidone "Accord" |
069663 |
84 stk. (unit-dose)
|
16.209,30 | 192,97 | 578,18 |
Substitution
| filmovertrukne tabletter 801 mg |
|---|
| Esbriet Roche, Pirfenidon, filmovertrukne tabletter 801 mg |
| Pirfenidone "Sandoz" Sandoz, Pirfenidon, filmovertrukne tabletter 801 mg |
| Pirfenidone Axunio Oresund Pharma, Pirfenidon, filmovertrukne tabletter 801 mg |
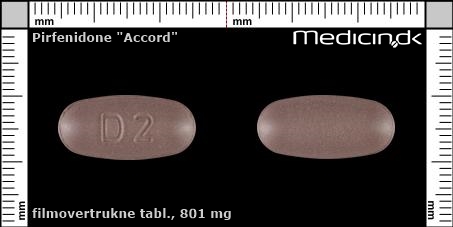
Foto og identifikation
Filmovertrukne tabletter 801 mg |
| Præg: |
D2
|
| Kærv: | Ingen kærv |
| Farve: | Brun |
| Mål i mm: | 10 x 21 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
6228. V. L. J. Proesmans, M. Drent, M. D. P. Elfferich et al. Self-reported Gastrointestinal Side Effects of Antifibrotic Drugs in Dutch Idiopathic Pulmonary Fibrosis patients. Lung. 2019; 197(5):551-58, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6778529/ (Lokaliseret 16. maj 2024)
5306. Lancaster L, Andrade JA, Zibrak JD et al. Pirfenidone safety and adverse event management in idiopathic pulmonary fibrosis. Eur Respir Rev. 2017; 26:146, https://pubmed.ncbi.nlm.nih.gov/29212837/ (Lokaliseret 23. oktober 2023)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



