Generel information
Relevante links
Middel mod overvægt og svær overvægt.
Anvendelsesområder
Som et supplement til kaloriefattig kost og øget fysisk aktivitet til vægtbehandling hos voksne med et start-BMI (Body Mass Index) på
- ≥ 30 kg/m² (svært overvægtig)
eller - ≥ 27 kg/m² (overvægtig) med vægtrelaterede komorbiditeter, såsom hypertension, type 2-diabetes eller dyslipidæmi.
Bemærk: Ingen erfaring vedr. sikkerhed og virkning ved kombination med andre midler til vægtreduktion. Samtidig anvendelse af sådanne midler frarådes.
Dispenseringsform
Kapsler, hårde. 1 kapsel indeholder
- 3,75 mg phentermin (som hydrochlorid) og 23 mg topiramat
- 7,5 mg phentermin (som hydrochlorid) og 46 mg topiramat
- 11,25 mg phentermin (som hydrochlorid) og 69 mg topiramat
- 15 mg phentermin (som hydrochlorid) og 92 mg topiramat.
Doseringsforslag
Voksne. Initialt 3,75/23 mg dgl. i 14 dage og derefter 7,5/46 mg dgl. Dosis tages 1 gang dgl. om morgenen.
Vurdering af behandlingseffekt efter 3 måneder:
- Ved vægttab på under 5 % (i forhold til vægt ved behandlingsstart) må det anses, at patienten ikke responderer og behandlingen seponeres.
- Ved vægttab på mindst 5 % og BMI ≥ 30 kg/m² samt hvis behandlingen er veltolereret, kan dosisøgning til 11,25/69 mg dgl. og efter 14 dage yderligere til 15/92 mg dgl. overvejes.
Bemærk:
- Der er set øget forekomst af bivirkninger ved doser på 15/92 mg dgl.
- Høj initialdosering og hurtig dosisøgning øger risikoen for udvikling af kognitive bivirkninger fra topiramat.
- Ved pausering af behandlingen i over 7 dage bør det overvejes at genstarte behandlingen med den lave initialdosis.
- Det anbefales at nedsætte det daglige fødeindtag med ca. 500 kcal under behandlingen.
- Ingen erfaring vedr. børn og unge under 18 år.
- Begrænset erfaring vedr. ældre over 70 år. Forsigtighed anbefales.
Glemt medicin
En glemt dosis tages senest midt på dagen samme dag. Ellers ventes til næste planlagte dosis. Der må ikke tages dobbeltdosis.
Håndtering af kapsler og tabletter
| kapsler med modificeret udløsning 11,25+69 mg, VIVUS |
| kapsler med modificeret udløsning 15+92 mg, VIVUS |
| kapsler med modificeret udløsning 3,75+23 mg, VIVUS |
| kapsler med modificeret udløsning 7,5+46 mg, VIVUS |
Mad og drikke
Kan tages med eller uden mad.
Knusning/åbning
Må ikke knuses.
Administration
Synkes hele med et glas vand.
Kapslen og indholdet må ikke tygges.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Kontraindiceret, erfaring savnes
GFR: 0-15 ml/min.
Erfaring savnes ved nyresygdom i slutstadiet eller for patienter i hæmodialyse. Behandling skal undgås.
Dosisjustering
GFR: 15-30 ml/min.
Initialdosis 3,75/23 mg hver anden dag. Hvis initialdosis er veltolereret, kan der efter 14 dage forsøges dosisøgning til højst 3,75/23 mg hver dag.
GFR: 30-60 ml/min.
Højst anbefalede dosis 3,75/23 mg dgl.
GFR: 60-90 ml/min.
Initialdosis 3,75/23 mg dgl. Hvis initialdosis er veltolereret, kan der efter 3 måneder (ved BMI ≥ 30 kg/m²) forsøges dosisøgning til højst 7,5/46 mg dgl.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
- Svært nedsat leverfunktion (Child-Pugh C): Erfaring savnes og behandling anbefales ikke.
- Moderat nedsat leverfunktion (Child-Pugh B): Højst anbefalede dosis 7,5/46 mg dgl.
- Let nedsat leverfunktion (Child-Pugh A): Ingen dosisjustering nødvendig.
Seponering
Ved høje doser på 15/92 mg kan pludselig seponering medføre risiko for kramper. Der anbefales gradvis nedtrapning med dosering hver anden dag i mindst en uge, før behandlingen seponeres helt.
Kontraindikationer
Behandling med MAO-hæmmere (isocarboxazid, linezolid, rasagilin, selegilin). Behandling med en irreversibel MAO-hæmmer (fx isocarboxazid) inden for de sidste 14 dage eller en reversibel MAO-hæmmer (fx linezolid) inden for det sidste døgn. Kombination af phentermin og MAO-hæmmere medfører risiko for blodtryksstigninger og hypertensiv krise.
Forsigtighedsregler
Kardiovaskulær påvirkning
- Takykardi, arytmier, atrieflimren og hypertension er forekommet under behandlingen.
- Monitorering af hjertefrekvens før og under behandlingen anbefales. Ved vedvarende stigninger i hvile-hjertefrekvens (fx > 90 slag/min.) anbefales dosisreduktion eller seponering.
- Erfaring savnes ved nyligt myokardieinfarkt (< 6 måneder) eller hjertesvigt NYHA II-IV, og behandling bør undgås.
- Pga. den kardiovaskulære påvirkning frarådes desuden anvendelse ved fremskreden kardiovaskulær sygdom som maligne arytmier og nylige (< 3 måneder) cerebrovaskulære tilfælde samt ved hyperthyreoidisme.
Monitorering af plasma-kreatinin
Måling af plasma-kreatinin anbefales før behandlingsstart og ved dosisøgning. Dosisreduktion eller seponering bør overvejes ved vedvarende stigning i plasma-kreatinin.
Risiko for depression
Der er set dosisrelateret risiko for humørsvingninger, udvikling af depression samt forværring af eksisterende depression ved behandling med midler indeholdende topiramat.
Bør ikke anvendes ved tidligere tilfælde af tilbagevendende svær depression, bipolar lidelse eller psykose samt ved aktuel moderat til svær depressiv episode.
Risiko for metabolisk acidose
Topiramat hæmmer carboanhydrase i nyrerne, hvilket øger risikoen for metabolisk acidose. Monitorering af bicarbonat i plasma anbefales ved andre risikofaktorer for udvikling af metabolisk acidose (fx behandling med metformin). Tegn på metabolisk acidose kan nødvendiggøre dosisnedsættelse eller seponering.
Risiko for misbrug
Phentermin virker svagt CNS-stimulerende og kan have misbrugspotentiale.
Risiko for nyresten
Topiramat medfører øget risiko for dannelse af nyresten. Adækvat hydrering anbefales.
Suicidaltanker- eller adfærd
Behandling med antiepileptika som topiramat er forbundet med en let øget risiko for suicidaltanker eller -adfærd. Efter markedsføring er der indberettet enkelte tilfælde af suicidaltanker og -forsøg ved anvendelse af Qsiva. Opmærksomhed på tegn på suicidaltanker eller -adfærd anbefales.
Udvikling af snævervinklet glaukom
Sulfonamid-afledte lægemidler som topiramat kan forårsage en idiosynkratisk reaktion, der medfører choroidal effusion med synsfeltsdefekter, forbigående myopi og akut vinkellukning (snævervinklet glaukom). Primær behandling er øjeblikkelig seponering. Omgående medicinsk eller kirurgisk behandling bør indsættes ved vedvarende forhøjet intraokulært tryk, da ubehandlet akut vinkellukning (snævervinklet glaukom) kan føre til permanent synstab. Iridotomi er ikke virksom, da tilstanden skyldes ødem af corpus ciliare.
Bivirkninger
Dette lægemiddel har skærpet indberetningspligt. Alle eventuelle bivirkninger ved brugen skal derfor indberettes til Lægemiddelstyrelsen, se Lægemiddelstyrelsen (Meld en bivirkning).
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Mundtørhed, Obstipation | |
| Nervesystemet | Paræstesier | |
| Almindelige (1-10 %) | ||
| Hjerte | Palpitationer | |
| Øjne | Sløret syn | Øjentørhed |
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Dyspepsi, Kvalme, Smagsforstyrrelser |
| Almene symptomer og reaktioner på administrationsstedet | Træthed | |
| Metabolisme og ernæring | Tørst | |
| Nervesystemet | Hukommelsesbesvær, Hypæstesi, Svimmelhed | Hovedpine |
| Psykiske forstyrrelser | Angst, Anorexia nervosa, Depression, Koncentrationsbesvær, Nervøsitet | Irritabilitet, Søvnløshed |
| Hud og subkutane væv | Alopeci | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Anæmi | |
| Hjerte | Takykardi, Øget hjertefrekvens | |
| Øre og labyrint | Tinnitus | |
| Øjne | Dobbeltsyn, Øjensmerter | Fotofobi, Lysglimt, Øjenkløe |
| Mave-tarm-kanalen | Flatulens, Gastro-øsofageal refluks, Opkastning, Ructus | |
| Almene symptomer og reaktioner på administrationsstedet | Letargi | Brændende fornemmelse, Føle sig unormal, Kraftesløshed, Kulde- eller varmefølelse |
| Lever og galdeveje | Leverpåvirkning | |
| Immunsystemet | Urticaria | |
| Undersøgelser | Nedsat plasma-bicarbonat, Nedsat plasma-kalium | |
| Metabolisme og ernæring | Dehydrering, Hypoglykæmi, Hypokaliæmi | Øget appetit |
| Knogler, led, muskler og bindevæv | Artralgi, Muskelkramper, Muskelsvaghed, Rygsmerter, Smerter i ekstremiteter | Muskelspændinger, Myalgi |
| Nervesystemet | Afasi, Koordinationsbesvær, Migræne, Neuropati, Tremor | Blefarospasme, Gråd, Restless legs syndrome |
| Psykiske forstyrrelser | Affektlabilitet, Aggressivitet, Agitation, Apati, Dysartri, Humørforstyrrelser, Hyperaktivitet, Kognitiv dysfunktion, Konfusion, Panikangst, Psykose (paranoia), Somnolens, Stress | Rastløshed, Søvnforstyrrelser (herunder abnorme drømme og mareridt), Øget energi |
| Nyrer og urinveje | Nyrefunktionspåvirkning, Nyresten, Urinvejsinfektion, Vandladningsbesvær | Nykturi, Polyuri |
| Det reproduktive system og mammae | Erektil dysfunktion | Brystsmerter, Menstruationsforstyrrelser, Ændring af libido |
| Luftveje, thorax og mediastinum | Dyspnø | Epistaxis, Hoste, Nasal tilstopning, Nasalsekretion, Smerter i øvre luftveje, Tilstoppede bihuler, Ændret lugtesans |
| Hud og subkutane væv | Erytem | Acne, Hudkløe, Hududslæt, Hårforandringer, Tør hud, Ændret kropslugt, Øget svedtendens |
| Vaskulære sygdomme | Hypertension, Hypotension, Perifere ødemer, Synkope, Ødemer | Flushing |
| Sjældne (0,01-0,1 %) | ||
| Hjerte | Arytmier, Atrieflimren | |
| Øre og labyrint | Høretab, Øreinfektion, Øresmerter | |
| Øjne | Glaukom | Konjunktival blødning, Tåreflåd |
| Mave-tarm-kanalen | Brændende fornemmelse på tungen, Dårlig ånde, Gingivale smerter, Glossitis, Hæmorider, Tænderskæren | |
| Lever og galdeveje | Cholecystitis | Galdesten |
| Infektioner og parasitære sygdomme | Candidiasis, Luftvejsinfektion | Influenzalignende symptomer |
| Traumer, forgiftninger og behandlingskomplikationer | Faldtendens | |
| Undersøgelser | Forhøjet blodglucose | Forhøjet plasma-kreatinin |
| Metabolisme og ernæring | Acidose, Anfald af arthritis urica | Nedsat appetit |
| Knogler, led, muskler og bindevæv | Muskelstivhed | |
| Nervesystemet | Gangforstyrrelser | |
| Psykiske forstyrrelser | Dysfemi, Hallucinationer, Suicidaltanker | Anhedoni |
| Nyrer og urinveje | Ændret urinlugt | |
| Luftveje, thorax og mediastinum | Rhinoré, Sinuitis, Tørhed i halsen | |
| Hud og subkutane væv | Negleforandringer | |
| Vaskulære sygdomme | Dyb venetrombose | |
| Ikke kendt hyppighed | ||
| Hjerte | Hjerteinsufficiens | |
| Øre og labyrint | Hyperakusis, Otitis media (effusion) | |
| Øjne | Blindhed (forbigående), Katarakt, Macula- og nethindedegeneration, Snævervinklet glaukom, Uveitis | Pupildilatation |
| Mave-tarm-kanalen | Gastroenteritis (viral), Synkebesvær, Ubehag i mundhulen | |
| Immunsystemet | Allergiske reaktioner, Angioødem | |
| Undersøgelser | Forhøjet HbA1c, Forhøjet plasmakoncentration af thyroideastimulerende hormon (TSH), Forhøjet triglycerid | |
| Metabolisme og ernæring | Nedsat plasma-glucose | |
| Knogler, led, muskler og bindevæv | Kramper | |
| Nervesystemet | Neuralgi | Logorré |
| Psykiske forstyrrelser | Depersonalisering, Suicidaladfærd | |
| Nyrer og urinveje | Akut nyreskade | |
| Luftveje, thorax og mediastinum | Respirationsstop | Næsepolypper |
Kliniske aspekter
- Generelt er bivirkningerne dosisrelaterede og ved doser på 15/92 mg dgl. ses øget forekomst af bivirkninger.
- Phentermin er et indirekte sympatomimetikum, der øger frigørelsen af noradrenalin. Den følgende beta2-agonistiske effekt har betydning for bivirkningsprofilen med bl.a. hjertepåvirkning.
- Topiramat har en bivirkningsprofil omfattende sedation, svimmelhed, paræstesier, en række kognitive/psykiske bivirkninger og risiko for nyrepåvirkning og udvikling af nyresten.
- Risikoen for paræstesier er dosisafhængig. Paræstesierne er normalt af lettere karakter og består oftest af prikken i hænder og fødder. Hos størstedelen af patienterne (op til 80 %) forsvandt paræstesierne spontant efter ca. 3 måneders behandling.
- Psykiske forstyrrelser (relateret til angst, søvnforstyrrelser og depression) er forekommet hos op til 20 %. Langt de fleste (94 %) i let til moderat form.
- Kognitive forstyrrelser ses hos noget færre (op til ca. 8 %) og består oftest af let til moderat nedsat hukommelse eller opmærksomhedsforstyrrelse.
- Hjerte-relaterede bivirkninger vil oftest være ikke-alvorlige former for arytmier, palpitationer og takykardi. Monitorering af hjertefrekvensen anbefales som beskrevet under forsigtighedsregler.
- Nyrefunktionen kan påvirkes med nedsat GFR medførende stigninger i plasma-kreatinin, der bør monitoreres som beskrevet under forsigtighedsregler.
Interaktioner
Påvirkning af P450-enzymer (CYP)
- Carbamazepin og phenytoin kan via enzyminduktion nedsætte koncentrationen af topiramat med henholdsvis 40-50 % og 50-70 % Risiko for samme effekt ved samtidig anvendelse af andre induktorer som fx perikon eller phenobarbital/primidon.
- Topiramat kan hæmme omsætningen af phenytoin via hæmning af CYP2C19.
- Topiramat inducerer CYP3A4. Forsigtighed ved samtidig anvendelse af CYP3A4-substrater pga. risiko for nedsat eller manglende effekt. Det gælder fx: Alfentanil og fentanyl, ciclosporin, imatinib, pimozid, everolismus, sirolimus og tacrolimus.
- Topiramat hæmmer CYP2C19. Mulig påvirkning af midler, der omsættes via CYP2C19 som fx diazepam eller proguanil.
- Se desuden tabel 2 i Elimination og cytokrom P450-systemet.
Lithium
Der er set både øget og nedsat plasmakoncentration af lithium ved kombination med topiramat. Kontrol af plasma-lithium anbefales efter start og ophør af behandling med Qsiva.
MAO-hæmmere
Samtidig behandling med phentermin og MAO-hæmmere medfører risiko for blodtryksstigninger og hypertensiv krise og kombinationen er kontraindiceret. Behandling med Qsiva må først startes mindst 14 dage efter seponering af en irreversibel MAO-hæmmer og mindst 24 timer efter seponering af en reversibel MAO-hæmmer.
Metformin
Topiramat kan øge plasmakoncentrationen af metformin med ca. 20 % Blodsukkermåling anbefales efter opstart eller seponering af Qsiva hos patienter i behandling med metformin.
Valproat
Ved samtidig behandling med topiramat og valproat er der set øget risiko for hyperammonæmi (med eller uden encefalopati) - sandsynligvis pga. additiv påvirkning af urinstofcyklus i leveren.
Østrogen
Topiramat nedsætter plasmakoncentrationen af østrogener og evt. også gestagener. Nedsættelsen vil normalt kun være klinisk relevant ved højere doser af topiramat (> 200 mg dgl.) end der anvendes ved behandling med Qsiva (6373).
Andre interaktioner
- Carboanhydrasehæmmere: Samtidig anvendelse af carboanhydrasehæmmere som acetazolamid kan øge risikoen for nyresten og forværre evt. acidose.
- Digoxin: Et studie har vist nedsættelse af plasmakoncentrationen for digoxin på ca. 12 % ved kombination med topiramat.
- Natriumoxybat: Der er set et tilfælde af stigning i plasmakoncentrationen på 1,8 gange af natriumoxybat ved samtidig anvendelse af topiramat med efterfølgende coma.
- Thiazider: Let øget eksponering af topiramat er set i et studie ved kombination med hydrochlorthiazid.
Graviditet
Baggrund: Der er ikke humane data for phentamin isoletet eller i kombination med topiramat. Topiramat er forbundet med en mindre overhyppighed af medfødte misdannelser og bør alene anvendes til gravide på indikationen epilepsi. Se topiramat.
Amning
Fertile kvinder: Der skal anvendes sikker kontraception og behandling må ikke påbegyndes uden en negativ graviditetstekst.
Trafik
Bloddonor
Doping

|
Anvendelse af Qsiva medfører diskvalifikation af den sportsudøvende i konkurrencer. |
Alkohol
Alkohol bør undgås ved behandling med CNS-stimulerende midler som Qsiva. Visse CNS-bivirkninger kan forstærkes af alkohol og der kan være mulig øget risiko for hjertepåvirkning og blodtryksforhøjelse.
Farmakodynamik
Phentermin
Virker appetitreducerende. Phentermin er en sympatomimetisk virkende amin med samme grundstruktur som amfetamin. Virker CNS-stimulerende og øger frigørelsen af noradrenalin. Ser ikke ud til at virke afhængighedsskabende i de doser, der anvendes ifm. vægtreduktion (6374).
Topiramat:
- Stabiliserer præsynaptiske neuronale membraner via blokade af spændingsafhængige natriumkanaler og hæmmer derved udskillelsen af ekscitatoriske aminer, specielt glutamat. Blokerer AMPA/kainat-receptorerne og potenserer den hæmmende virkning af GABA.
- Mekanismen bag den vægtreducerende effekt er ikke fuldt belyst. Skyldes muligvis en reduktion i energioptaget, mindsket fedtdeponering og reducerede niveauer af triglycerider og kolesterol. Topiramat påvirker muligvis leptin-syntesen og reducerede niveauer af leptin er set ved behandling med topiramat (6375).
Farmakokinetik
Phentermin
- Biotilgængelighed 75-85 %
- Maksimal plasmakoncentration ca. 6 timer (Tmax) efter administration af kapsler med modificeret udløsning.
- Fordelingsvolumen 5,3 l/kg.
- Plasmahalveringstid ca. 20 timer.
- Udskilles primært uomdannet gennem nyrerne. Eliminationen er pH-afhængig og øges ved lav pH og hæmmes ved mere basisk urin.
Topiramat:
- Biotilgængelighed 81-95 %.
- Maksimal plasmakoncentration ca. 10 timer (Tmax) efter administration af kapsler med modificeret udløsning.
- Fordelingsvolumen 1,1 l/lg.
- Steady state efter 4-5 døgn.
- Plasmahalveringstid 49 timer.
- Udskilles primært uomdannet gennem nyrerne.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| kapsler med modificeret udløsning | 3,75+23 mg |
Phentermin (3,75 mg)
Topiramat (23 mg)
|
Farve
Andre
|
| 7,5+46 mg |
Phentermin (7,5 mg)
Topiramat (46 mg)
|
Farve
Andre
|
|
| 11,25+69 mg |
Phentermin (11,25 mg)
Topiramat (69 mg)
|
Farve
Andre
|
|
| 15+92 mg |
Phentermin (15 mg)
Topiramat (92 mg)
|
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (AP4) | kapsler med modificeret udløsning
3,75+23 mg
Qsiva |
183306 |
30 stk.
|
1.281,85 | 42,73 | ||
| (AP4) | kapsler med modificeret udløsning
7,5+46 mg
Qsiva |
056827 |
30 stk.
|
1.281,85 | 42,73 | ||
| (AP4) | kapsler med modificeret udløsning
11,25+69 mg
Qsiva |
100781 |
30 stk.
|
1.281,85 | 42,73 | ||
| (AP4) | kapsler med modificeret udløsning
15+92 mg
Qsiva |
466663 |
30 stk.
|
1.281,85 | 42,73 |
Foto og identifikation
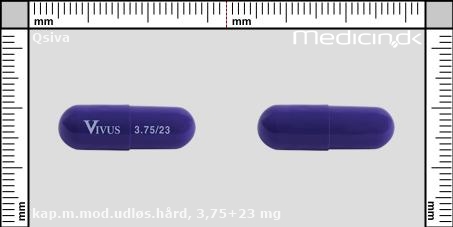
Kapsler med modificeret udløsning 3,75+23 mg |
| Præg: |
Vivus, 3.75/23
|
| Kærv: | Ikke relevant |
| Farve: | Lilla |
| Mål i mm: | 23,1 x 7,5 |
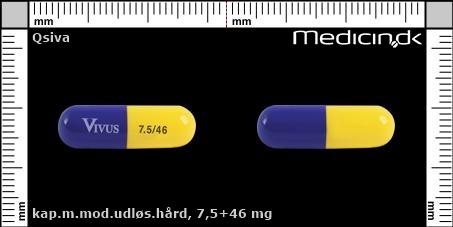
Kapsler med modificeret udløsning 7,5+46 mg |
| Præg: |
Vivus, 7.5/46
|
| Kærv: | Ikke relevant |
| Farve: | Gul, Lilla |
| Mål i mm: | 23,1 x 7,5 |
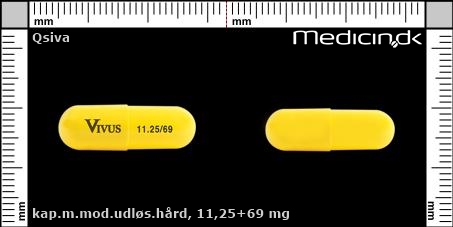
Kapsler med modificeret udløsning 11,25+69 mg |
| Præg: |
Vivus, 11.25/69
|
| Kærv: | Ikke relevant |
| Farve: | Gul |
| Mål i mm: | 23,1 x 7,5 |
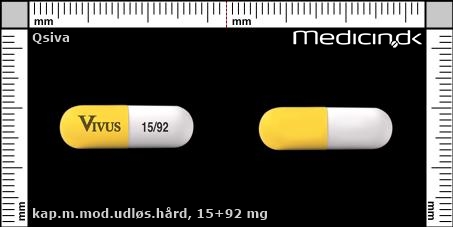
Kapsler med modificeret udløsning 15+92 mg |
| Præg: |
Vivus, 15/92
|
| Kærv: | Ikke relevant |
| Farve: | Gul, Hvid |
| Mål i mm: | 23,1 x 7,5 |
Referencer
6375. Wajid I, Vega A, Thornhill K et al. Evolving Role in Weight Reduction Management: A Narrative Review. Life. 2023; 19(9):1845, https://pmc.ncbi.nlm.nih.gov/articles/PMC10532729/ (Lokaliseret 6. november 2024)
6374. Hendricks EJ, Srisurapanont M, Schmidt SL et al. Addiction potential of phentermine prescribed during long-term treatment of obesity. Int J Obes (Lond). 2014; 38(2):292-8, https://pubmed.ncbi.nlm.nih.gov/23736363/ (Lokaliseret 6. november 2024)
6373. Doose DR, Wang SS, Padmanabhan M et al. Effect of topiramate or carbamazepine on the pharmacokinetics of an oral contraceptive containing norethindrone and ethinyl estradiol in healthy obese and nonobese female subjects. Epilepsia. 2003; 44(4):540-9, https://pubmed.ncbi.nlm.nih.gov/12681003/ (Lokaliseret 6. november 2024)



