Generel information
Anvendelsesområder
- Svær psoriasis, hvor konventionel terapi har vist sig uden effekt.
- Kan anvendes i kombination med PUVA-behandling, UVB-behandling eller lokalbehandling.
- Svært invaliderende tilfælde af morbus Darier hos voksne.
Behandlingen bør forestås af speciallæger i dermatologi.
Dispenseringsform
Kapsler, hårde. 1 kapsel indeholder 10 mg eller 25 mg acitretin.
Doseringsforslag
Individuel.
Voksne
- Initialt 25-30 mg dgl. fordelt på 1-3 doser i 2-4 uger.
- Døgndosis må ikke overstige 75 mg.
- Når terapeutisk effekt er opnået, justeres dosis, afhængig af individuel tolerance.
Børn
- 0,5 mg/kg legemsvægt i døgnet.
- I svære tilfælde op til 1 mg/kg legemsvægt i døgnet i en begrænset periode.
- Døgndosis må ikke overstige 35 mg.
I kombination med PUVA- eller lysbehandling kan dosis oftest reduceres.
Håndtering af kapsler og tabletter
| hårde kapsler 10 mg, TEVA |
| hårde kapsler 25 mg, TEVA |
| hårde kapsler 25 mg, TEVA (2care4) |
Mad og drikke
Bør tages med et måltid eller glas mælk for at opnå bedst mulig virkning.
Indholdet kan kommes på blød mad, fx yoghurt eller æblemos.
Knusning/åbning
Kan åbnes.
Administration
Synkes hele med et glas vand.
Indholdet kan opslæmmes i vand.
Andet
Bemærk - personalerisiko: Ved håndtering af dette lægemiddel bør udvises forsigtighed.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Kontraindiceret, erfaring savnes
GFR: 0-30 ml/min.
Kontraindiceret pga. manglende data.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
Kontraindikationer
- Forhøjet blodlipidniveau
- Hypervitaminosis A
- Der bør i behandlingsperioden ikke gives tilskud af A-vitamin.
- Samtidig brug af tetracycliner eller methotrexat, se interaktioner.
Forsigtighedsregler
På grund af nedsat effekt af hormonale kontraceptiva ved samtidig indgift af acitretin, tilrådes det at supplere med en anden kontraceptionsmetode.
Kontrolforanstaltninger
- Kontrol af leverfunktion, P-kreatinin, P-kolesterol og P-triglycerider skal foretages, før behandlingen indledes samt hver 3. måned, så længe behandlingen varer.
- Behandling af kvinder i den fertile alder må kun finde sted, når der forud er draget omsorg for:
- at kvinden ikke er gravid
- at der anvendes sikker antikonception, der skal fortsættes i mindst 3 år efter seponering af behandlingen
- graviditetstest 1 gang månedligt tilrådes
- kvinden er informeret om, at der i tilfælde af graviditet under behandlingen vil være tungtvejende grunde til at anbefale svangerskabsafbrydelse.
Vælges p-piller som antikonception, bør behandlingen med acitretin først indledes i 2. p-pille-cyklus.
Knogleforandringer
- Patienter i længerevarende behandling bør undersøges med jævne mellemrum for så tidligt som muligt at afsløre evt. ændringer i knoglevæv.
- Ved tegn på knogleforandringer må fortsættelse af behandlingen vurderes.
Risiko for psykiske bivirkninger
Psykiske bivirkninger som angst, humørændringer og depression er forekommet ifm. behandling med retinoider. Forsigtighed og øget opmærksomhed på depressive symptomer ved depression i anamnesen.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Cheilitis, Mundtørhed, Tørre læber | |
| Undersøgelser | Forhøjede levertransaminaser | |
| Metabolisme og ernæring | Hyperkolesterolæmi, Hypertriglyceridæmi* | Tørst |
| Luftveje, thorax og mediastinum | Epistaxis, Rhinitis, Tørhed i næsen | |
| Hud og subkutane væv | Alopeci | Hudkløe, Tør hud |
| Almindelige (1-10 %) | ||
| Øjne | Conjunctivitis, Keratitis | Øjentørhed |
| Mave-tarm-kanalen | Abdominalsmerter, Stomatitis | Diarré, Kvalme, Opkastning |
| Traumer, forgiftninger og behandlingskomplikationer | Intolerance over for kontaktlinser | |
| Knogler, led, muskler og bindevæv | Artralgi | Myalgi |
| Hud og subkutane væv | Onykoreksi, Rødme, Seborré | |
| Vaskulære sygdomme | Perifere ødemer | |
| Ikke almindelige (0,1-1 %) | ||
| Øjne | Sløret syn | |
| Mave-tarm-kanalen | Gingival blødning | |
| Lever og galdeveje | Hepatitis | |
| Nervesystemet | Hovedpine | |
| Hud og subkutane væv | Fotosensibilitet | |
| Sjældne (0,01-0,1 %) | ||
| Nervesystemet | Svimmelhed | |
| Meget sjældne (< 0,01 %) | ||
| Øjne | Corneal ulceration, Natteblindhed | |
| Mave-tarm-kanalen | Rektal blødning | Smagsforstyrrelser |
| Lever og galdeveje | Icterus | |
| Knogler, led, muskler og bindevæv | Osteomalaci | |
| Nervesystemet | Benign intrakraniel trykstigning, Paræstesier, Perifer neuropati | |
| Ikke kendt hyppighed | ||
| Øre og labyrint | Høretab, Tinnitus | |
| Øjne | Tab af øjenvipper og -bryn | |
| Immunsystemet | Angioødem, Hypersensitivitetsreaktioner | Urticaria |
| Psykiske forstyrrelser | Humørforstyrrelser, Psykose | |
| Det reproduktive system og mammae | Vulvovaginitis | |
| Luftveje, thorax og mediastinum | Dysfoni | |
| Hud og subkutane væv | Eksfoliativ dermatitis, Erytem | |
| Vaskulære sygdomme | Systemisk vaskulær lækage-syndrom | |
* Behandlingen bør seponeres i tilfælde af ukontrollerede niveauer af hypertriglyceridæmi, eller hvis der opstår symptomer på pankreatitis.
Kliniske aspekter
Bivirkninger ses hos de fleste patienter, men forsvinder typisk, når dosis reduceres eller behandlingen seponeres.
En indledende forværring af psoriasis symptomerne ses undertiden i begyndelsen af behandlingsperioden, mens de hyppigst observerede bivirkninger på længere sigt er symptomer på hypervitaminose A (fx tørhed af læberne), som kan afhjælpes ved anvendelse af en fed salve.
Interaktioner
- Samtidig behandling med tetracycliner skal undgås, da dette kan øge frekvensen af bivirkningen, benign intrakraniel trykstigning.
- Samtidig indgift af methotrexat øger risikoen for levertoksicitet.
- Effekten af hormonale kontraceptiva nedsættes af acitretin.
- Acitretin nedsætter delvist phenytoins proteinbinding. Den kliniske betydning af dette er dog endnu ukendt.
Graviditet
Baggrund: Der er risiko for teratogenicitet. Der er meget få data. Acitretin er beslægtet med tretinoin, der er et potent teratogen, og acitretin må derfor ikke anvendes under graviditet.
Se endvidere Retinoider mod psoriasis.
Se også Klassifikation - graviditet
Fertile kvinder og mænd
For behandling af kvinder med acitretin gælder specifikke regler i forhold til udlevering, graviditetstest og kontraception. Der henvises til forsigtighedsreglerne og produktresuméet.
Amning
Bloddonor
Doping

|
Ingen restriktioner |
Alkohol
Kvinder der ønsker at blive gravide, skal undgå at drikke alkohol under samt 2 måneder efter endt behandling.
Etretinat kan dannes ved samtidig indtagelse af Neotigason® og alkohol. Etretinat er meget teratogent og har en længere halveringstid (ca. 120 dage) end acitretin.
Forgiftning
Symptomer på hypervitaminosis A. Symptomer på akut vitamin A-toksicitet omfatter hovedpine, kvalme, opkastning, omtågethed, irritabilitet, papilødem, dobbeltsyn, døsighed, øget intrakranielt tryk, hypercalcæmi, hypertriglyceridæmi og pruritus.
Farmakodynamik
Syntetisk retinsyreanalog.
Acitretin normaliserer epidermiscellernes proliferation, differentiering og forhorning.
Virkningen er symptomatisk, og mekanismen er for nærværende stort set ukendt.
Farmakokinetik
- Biotilgængelighed ca. 40 %. Samtidig fødeindtagelse forøger biotilgængeligheden til ca. 80 %.
- Maksimal plasmakoncentration efter 1-4 timer.
- Metaboliseres i leveren til de aktive metabolitter 13-cis-acitretin og etretinat.
- Plasmahalveringstid ca. 50 timer (acitretin), ca. 60 timer (13-cis-acitretin) og ca. 120 dage (etretinat). Enterohepatisk recirkulation forekommer
- Udskilles med galden og gennem nyrerne.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| hårde kapsler | 10 mg |
Farve
Andre
|
|
| 25 mg |
Farve
Andre
|
||
| 25 mg (2care4) |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (NBS) (Derm.Ven.) | hårde kapsler
10 mg
(kan dosisdisp.)
Neotigason |
488767 |
50 stk.
|
403,85 | 8,08 | 28,27 | |
| (NBS) (Derm.Ven.) | hårde kapsler
25 mg
(kan dosisdisp.)
Neotigason |
488791 |
50 stk. (blister)
|
582,55 | 11,65 | 16,31 | |
| (NBS) (Derm.Ven.) | hårde kapsler
25 mg
(2care4)
(kan dosisdisp.)
Neotigason |
121642 |
50 stk. (blister)
|
588,20 | 11,76 | 16,47 |
Substitution
| hårde kapsler 10 mg |
|---|
| Acitretin "Orifarm" Orifarm Generics, Acitretin, hårde kapsler 10 mg |
| hårde kapsler 25 mg |
|---|
| Acitretin "Orifarm" Orifarm Generics, Acitretin, hårde kapsler 25 mg |
Foto og identifikation
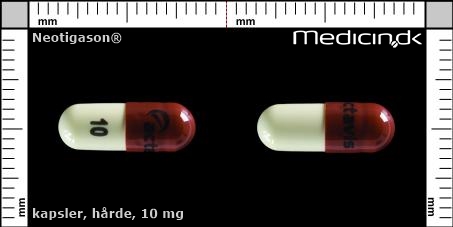
Hårde kapsler 10 mg |
| Præg: |
Actavis, 10,
 |
| Kærv: | Ikke relevant |
| Farve: | Hvid, Brun |
| Mål i mm: | 5 x 14 |
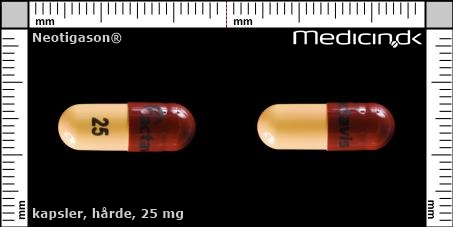
Hårde kapsler 25 mg |
| Præg: |
Actavis, 25,
 |
| Kærv: | Ikke relevant |
| Farve: | Gul, Brun |
| Mål i mm: | 6,5 x 19 |
Hårde kapsler 25 mg (2care4) |
| Præg: |
25
|
| Kærv: | Ikke relevant |
| Farve: | Gul, Brun |
| Mål i mm: | 19,2 x 7 |

Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
4051. Schaefer C, Meister R, Weber-Schoendorfer C. Isotretinoin exposure and pregnancy outcome: an observational study of the Berlin Institute for Clinical Teratology and Drug Risk Assessment in Pregnancy. Arch Gynecol Obstet. 2010; 281(2):221-7, https://www.ncbi.nlm.nih.gov/pubmed/19444462 (Lokaliseret 24. februar 2022)
4049. Dai WS, LaBraico JM, Stern RS. Epidemiology of isotretinoin exposure during pregnancy. J Am Acad Dermatol. 1992; 26(4):599-606, https://www.ncbi.nlm.nih.gov/pubmed/1597546 (Lokaliseret 24. februar 2022)
4050. Lammer EJ, Chen DT, Hoar RM et al. Retinoic acid embryopathy. N Engl J Med. 1985; 313(14):837-41, https://www.ncbi.nlm.nih.gov/pubmed/3162101 (Lokaliseret 24. februar 2022)
1550. SPC, Lægemiddelstyrelsen. , http://www.produktresume.dk (Lokaliseret 17. marts 2023)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)
3966. SPC, EMA. European Medicines Agency. , https://www.ema.europa.eu/en/medicines (Lokaliseret 6. februar 2024)



