Yderligere information
Generel information
Anvendelsesområder
- Hud-, negle- og slimhindemykoser forårsaget af Candida spp., Malassezia spp. og dermatofytter samt Aspergillus spp.
- Kan desuden anvendes ved systemiske mykoser forårsaget af gærsvampe, Aspergillus spp. (efter induktion)
- Anbefales som førstevalg til visse endemiske dimorfe svampeinfektioner, specielt histoplasmose
- Se endvidere:
- Tabel 2 og tabel 3 i Midler mod profunde og systemiske mykoser (systemiske svampeinfektioner)
- Tabel 1 i Svampeinfektioner i huden.
Dispenseringsform
Kapsler. 1 kapsel indeholder 100 mg itraconazol.
Doseringsforslag
Akut vulvo-vaginal candidiasis
- Voksne. 200 mg morgen og aften i 1 dag eller 200 mg dgl. i 3 dage.
Kronisk recidiverende vulvo-vaginal candidiasis
- Voksne. Akut behandling efterfulgt af 200 mg på 5. dag og 200 mg på 6. dag i cyklus.
- Kan øges til 200-400 mg dgl. i 2 dage ugentlig eller med 2-4 ugers interval i op til 6 måneder.
Pityriasis versicolor
- Voksne. 200 mg dgl. i 1 uge.
Ikke kronisk dermatofytose og kutan candidiasis
- Voksne. 200 mg dgl. i 1 uge.
Kronisk mukokutan candidiasis
- Voksne. 200 mg dgl. i 3 mdr.
Svampekeratitis
- Voksne. 200 mg dgl. i 3 uger.
Palmo-plantar dermatofytose
- Voksne. 200 mg 2 gange dgl. i 1 uge.
Oral candidiasis
- Voksne. 100 mg 1 gang dgl. i 2 uger.
Kronisk oral candidiasis inkl. immundefekt
- Voksne. 200 mg 1 gang dgl. i 4 uger.
Onykomykose
- Voksne
- 200 mg 2 gange dgl. i 1 uge
- Gentaget 1 gang med 3 ugers pause (fingernegle) eller 2 gange med 3 ugers pause (tånegle).
- Voksne
- Alternativt 200 mg dgl. i 3 mdr.
Tinea corporis
- Voksne. 100 mg 1 gang dgl. i 2 uger.
Tinea pedis
- Voksne. 100 mg 2 gange dgl. i 4 uger eller 200 mg 2 gange dgl. i 1 uge.
Bemærk:
- Kapslerne skal synkes hele med et glas vand.
- Kapslerne må ikke åbnes.
- Kapslerne tages umiddelbart efter et måltid.
- Biotilgængeligheden er varierende, og serumkoncentrationsmåling anbefales ved alvorlige infektioner.
- Bør ikke anvendes til børn.
Håndtering af kapsler og tabletter
| hårde kapsler 100 mg, Janssen |
| hårde kapsler 100 mg, Janssen (Epione) kærv: ikke oplyst |
Mad og drikke
Tages umiddelbart efter et måltid.
Knusning/åbning
Må ikke åbnes.
Administration
Synkes hele med et glas vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Forsigtighed, betinget
GFR: 0-60 ml/min.
Forsigtighed tilrådes.
Samtidig brug af clarithromycin, colchicin, fesoterodin og solifenacin er kontraindiceret.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
Forsigtighed tilrådes, da der er begrænset erfaring ved nedsat leverfunktion.
Kontraindikationer
- Bør ikke anvendes til patienter med kendt leversygdom eller hjerteinsufficiens.
- Samtidig behandling med en lang række CYP3A4-substrater, herunder lægemidler med snævert terapeutisk indeks eller med risiko for QT-forlængelse, er kontraindiceret, fx (der henvises til produktresumeet for yderligere information):
- aliskiren
- avanafil
- clarithromycin, colchicin, fesoterodin og solifenacin hos patienter med nedsat nyrefunktion
- dabigatran
- domperidon
- eplerenon
- ergot-alkaloider
- erythromycin
- felodipin
- irinotecan
- venetoclax (hos patienter med kronisk lymfatisk leukæmi i opstarts- og under dosistiteringsfasen for venetoclax)
- isavuconazol
- ivabradin
- lercanidipin
- lurasidon
- midazolam (oral)
- naloxegol
- nifedipin
- pimozid
- sertindol
- sildenafil (mod pulmonal hypertension)
- simvastatin
- triazolam
- vardenafil (ved > 75 år).
- Eliglustat ved samtidig behandling med stærk-moderat CYP2D6-hæmmer.
- Vincristin.
Forsigtighedsregler
Ved behandling af systemiske mykoser bør terapeutisk niveau sikres ved plasmakoncentrationsmåling.
Typiske alvorlige fejl
| Beskrivelse | Konsekvens |
|---|---|
| Overset interaktion med vitamin K-antagonister (warfarin). | Indlæggelse for justering af INR-værdi. |
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Kvalme |
| Nervesystemet | Hovedpine | |
| Ikke almindelige (0,1-1 %) | ||
| Mave-tarm-kanalen | Diarré, Obstipation, Opkastning | |
| Lever og galdeveje | Leverpåvirkning | |
| Immunsystemet | Hypersensitivitet | Urticaria |
| Nervesystemet | Svimmelhed | |
| Det reproduktive system og mammae | Menstruationsforstyrrelser | |
| Hud og subkutane væv | Alopeci | Hudkløe, Hududslæt |
| Sjældne (0,01-0,1 %) | ||
| Blod og lymfesystem | Leukopeni | |
| Hjerte | Bradykardi, Hjerteinsufficiens | |
| Øre og labyrint | Høretab, Tinnitus | |
| Øjne | Synsforstyrrelser | |
| Mave-tarm-kanalen | Pancreatitis | |
| Immunsystemet | Anafylaktisk reaktion, Angioødem, Serumsygdomslignende reaktioner, Stevens-Johnsons syndrom | |
| Nervesystemet | Paræstesier | |
| Hud og subkutane væv | Eksfoliativ dermatitis, Erythema multiforme, Toksisk epidermal nekrolyse (TEN) | |
| Ikke kendt hyppighed | ||
| Blod og lymfesystem | Neutropeni, Trombocytopeni | |
| Lever og galdeveje | Fulminant leversvigt, Hepatitis | |
| Undersøgelser | Elektrolytforstyrrelser (pseudoaldosteronisme) | |
| Nervesystemet | Perifer neuropati | |
| Luftveje, thorax og mediastinum | Lungeødem | |
Kliniske aspekter
De hyppigste bivirkninger i klinisk praksis er dyspepsi. Grundet risiko for lever - og knoglemarvspåvirkning anbefales regelmæssig kontrol ved længerevarende behandling. I sjældne tilfælde kan der forekomme alvorlige bivirkninger fra huden i form af Stevens-Johnsons syndrom eller toksisk epidermal nekrolyse.
Interaktioner
- Itraconazol er en potent hæmmer af CYP3A4, og der er risiko for øget plasmakoncentration af lægemidler, der nedbrydes af dette enzym.
- Samtidig behandling med en række CYP3A4-substrater, herunder lægemidler med snævert terapeutisk indeks eller med risiko for QT-forlængelse, er kontraindiceret, fx:
- aliskiren
- avanafil
- dabigatran
- domperidon
- eplerenon
- ergotalkaloider
- erythromycin
- felodipin
- irinotecan
- isavuconazol
- ivabradin
- lercanidipin
- lurasidon
- midazolam (oralt)
- naloxegol
- nifedipin
- pimozid
- sertindol
- sildenafil (mod pulmonal hypertension)
- simvastatin
- triazolam
- vardenafil (ved > 75 år).
- Se endvidere Elimination og cytokrom P450-systemet.
- Itraconazol øger plasmakoncentrationen af clarithromycin, colchicin, fesoterodin og solifenacin. Kombination er kontraindiceret hos patienter med nedsat nyrefunktion.
- Eliglustat er kontraindiceret ved samtidig behandling med stærk-moderat CYP2D6-hæmmer.
- Vincristin er pga. øget risiko for neurotoksicitet kontraindiceret.
- Ved samtidig brug af vinorelbin er der øget risiko for neurotoksicitet, og dosis af vinorelbin bør derfor reduceres.
- Ved samtidig behandling med atorvastatin bør dosis af atorvastatin nedsættes, og der skal være tæt monitorering mht. muskelbivirkninger.
- Samtidig brug af buspiron eller busulfan kræver nedsat dosis af buspiron/busulfan.
- For andre lægemidler, der nedbrydes via CYP3A4, kan også forventes øgede plasmakoncentrationer med muligt behov for dosisjustering, herunder bl.a. HIV-proteasehæmmere, fosfodiesterasehæmmere som sildenafil og tadalafil, ciclosporin og carbamazepin.
- Itraconazol kan potensere virkningen af warfarin.
- Kraftige CYP3A4-induktorer som rifampicin, rifabutin, phenytoin og naturlægemidler med perikon nedsætter biotilgængeligheden af itraconazol med risiko for behandlingssvigt. Kombination kræver dosisøgning af itraconazol og/eller dosisreduktion af den kraftige CYP3A4-induktor-induktor. Samtidig behandling bør dog undgås under itraconazolbehandling og i op til 2 uger før behandlingsstart.
- Ved samtidig brug af meloxicam ses virkningen af meloxicam først efter 48 timer. Kombination bør undgås eller anvendes med forsigtighed under hensyntagen til forsinket virkning af meloxicam.
- Itraconazol kan hæmme metabolismen af calciumantagonister og dermed øge risikoen for hjerteinsufficiens.
- Antacida hæmmer virkningen af itraconazol. Derfor bør antacida indtages mindst 1 time før eller mindst 2 timer efter indtagelse af itraconazol.
- Se endvidere tabel 1 i Midler mod profunde og systemiske mykoser (systemiske svampeinfektioner).
- Der henvises til produktresumeet for yderligere information.
Graviditet
Baggrund: Der er data for knap 500 1. trimester-eksponerede uden tegn på overhyppighed af misdannelser. Den begrænsede datamængde tillader ikke at udelukke en vis øget risiko. Et enkelt studie har vist en øget forekomst af spontan abort efter eksponering i 1. trimester. På grund af den mulige dosisrelaterede teratogene effekt af et andet azol, fluconazol, må itraconazol ikke anvendes. Se endvidere Midler mod profunde og systemiske mykoser (systemiske svampeinfektioner).
Amning
Baggrund: Den relative vægtjusterede dosis er beregnet til 0,2 %, hvilket er lavt. Itraconazol har et stort fordelingsvolumen og opkoncentreres i fedtvæv, nyre og lever, og ved længerevarende behandling må man forvente en højere koncentration i modermælken. Der er ikke beskrevet bivirkninger hos barnet.
Bloddonor
Ingen karantæne ved tapning af plasma til fraktionering.
Alkohol
Alkohol og Sporanox® påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
- Hæmmer ergosterolsyntesen, da itraconazol bremser omdannelse af lanosterol til ergosterol via hæmning af det cytokrom P450-afhængige enzym 14-steroldemethylase.
- Er overvejende fungistatisk.
- Itraconazol er aktivt over for:
- Candida albicans
- Cryptococcus neoformans
- Dermatofytter
- Skimmelsvampe (bl.a. Aspergillus spp.)
- Dimorfe svampe (Histoplasma, Coccidioides og Blastomyces)
- Flere fæohyfomyceter.
Farmakokinetik
- Biotilgængelighed ca. 55 % (højst ved indtagelse umiddelbart efter et måltid).
- Maksimal plasmakoncentration efter 2-5 timer.
- Steady state efter ca. 15 dage.
- Metaboliseres i leveren primært via CYP3A4 til aktiv hovedmetabolit.
- Terminal plasmahalveringstid 34-42 timer efter gentagne doser.
- Under 1 % udskilles uomdannet gennem nyrerne.
- Se endvidere tabel 1 i Midler mod profunde og systemiske mykoser (systemiske svampeinfektioner).
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| hårde kapsler | 100 mg |
Farve
Andre
|
|
| 100 mg (Epione) |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | hårde kapsler
100 mg
(Epione)
(kan dosisdisp.)
Sporanox |
394645 |
14 stk. (blister)
|
448,60 | 32,04 | 64,09 | |
| (B) | hårde kapsler
100 mg
(kan dosisdisp.)
Sporanox |
155648 |
28 stk. (blister)
|
445,95 | 15,93 | 31,85 | |
| (B) | hårde kapsler
100 mg
(Epione)
(kan dosisdisp.)
Sporanox |
424233 |
28 stk. (blister)
|
298,40 | 10,66 | 21,31 |
Substitution
Foto og identifikation
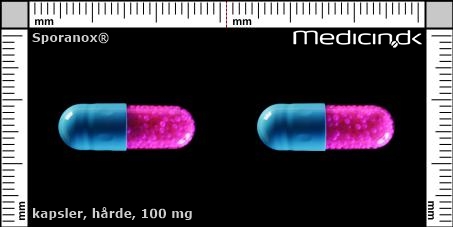
Hårde kapsler 100 mg |
| Præg: |
Intet præg
|
| Kærv: | Ikke relevant |
| Farve: | Gennemsigtig, Pink, Blå |
| Mål i mm: | 7,4 x 21,6 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
4335. Pasternak B, Wintzell V, Furu K et al. Oral Fluconazole in Pregnancy and Risk of Stillbirth and Neonatal Death. JAMA. 2018; 319(22):2333-5, https://www.ncbi.nlm.nih.gov/pubmed/29896619 (Lokaliseret 3. marts 2022)
4336. Howley MM, Carter TC, Browne ML et al. Fluconazole use and birth defects in the National Birth Defects Prevention Study. Am J Obstet Gynecol. 2016; 214(5), https://www.ncbi.nlm.nih.gov/pubmed/26640069 (Lokaliseret 3. marts 2022)
4337. Mølgaard-Nielsen D, Svanström H, Melbye M et al. Association Between Use of Oral Fluconazole During Pregnancy and Risk of Spontaneous Abortion and Stillbirth. JAMA. 2016; 315(1):58-67, https://www.ncbi.nlm.nih.gov/pubmed/26746458 (Lokaliseret 3. marts 2022)
4338. Alsaad AM, Kaplan YC, Koren G. Exposure to fluconazole and risk of congenital malformations in the offspring: A systematic review and meta-analysis. Reprod Toxicol. 2015; 52:78-82, https://www.ncbi.nlm.nih.gov/pubmed/25724389 (Lokaliseret 3. marts 2022)
4339. Mølgaard-Nielsen D, Pasternak B, Hviid A. Use of oral fluconazole during pregnancy and the risk of birth defects. N Engl J Med. 2013; 369(9):830-9, https://www.ncbi.nlm.nih.gov/pubmed/23984730 (Lokaliseret 3. marts 2022)
4333. De Santis M, Di Gianantonio E, Cesari E et al. First-trimester itraconazole exposure and pregnancy outcome: a prospective cohort study of women contacting teratology information services in Italy. Drug Saf. 2009; 32(3):239-44, https://www.ncbi.nlm.nih.gov/pubmed/19338381 (Lokaliseret 3. marts 2022)
1924. Nørgaard M, Pedersen L, Gislum M et al. Maternal use of fluconazole and risk of congenital malformations: a Danish population-based cohort study. J Antimicrob Chemother. 2008; 62:172-6, http://www.ncbi.nlm.nih.gov/pubmed/18400803 (Lokaliseret 7. februar 2022)
4334. Bar-Oz B, Moretti ME, Bishai R et al. Pregnancy outcome after in utero exposure to itraconazole: a prospective cohort study. Am J Obstet Gynecol. 2000; 183(3):617-20, https://www.ncbi.nlm.nih.gov/pubmed/10992182 (Lokaliseret 3. marts 2022)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



