Generel information
Anvendelsesområder
- Monoterapi og supplerende behandling ved epilepsi med fokale anfald og fokale anfald, der spreder sig til bilaterale tonisk kloniske anfald.
- Supplerende behandling af absencer, myoklonier og generaliserede toniske-kloniske inkl. behandling af anfald ved juvenil myoklon epilepsi. Se endvidere Epilepsi hos voksne.
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 250 mg (delekærv), 500 mg (delekærv), 750 mg (delekærv) og 1.000 mg (delekærv) levetiracetam.
Doseringsforslag
Monoterapi
- Voksne og børn > 16 år. Initialt 250 mg 2 gange dgl.
Efter 2 uger kan dosis øges til 500 mg 2 gange dgl.
Dosis kan øges med yderligere 250 mg 2 gange dgl. hver 2. uge til højst 1,5 g 2 gange dgl.
Supplerende behandling
- Voksne og unge > 50 kg. Initialt 500 mg 2 gange dgl. i 1 uge.
Døgndosis kan evt. øges med 500-1.000 mg hver 2.-4. uge til 1,5 g 2 gange dgl. - Spædbørn fra 1 mdr. samt børn og unge < 50 kg. Initialt 10 mg/kg legemsvægt 2 gange dgl.
Døgndosis kan evt. øges med 10 mg/kg legemsvægt 2 gange dgl. hver 2. uge til 30 mg/kg legemsvægt.
Bemærk:
- Tabletterne synkes hele eller halve med et glas vand.
- Tabletterne kan knuses.
- Knust tablet kan opslæmmes i vand.
- Knust tablet kan kommes på kold, blød mad.
- Kan tages med eller uden mad.
- Skift fra i.v. til oral administration kan foretages direkte uden dosistitrering.
- Ældre. Dosis bør nedsættes.
- Til spædbørn skal oral opløsning indeholdende levetiracetam anvendes.
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 250 mg, 1A Farma Delekærv |
| filmovertrukne tabletter 500 mg, 1A Farma Delekærv |
| filmovertrukne tabletter 750 mg, 1A Farma Delekærv |
| filmovertrukne tabletter 1000 mg, 1A Farma Delekærv |
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Knust tablet kan kommes på kold, blød mad.
Knusning/åbning
Kan knuses.
Administration
Synkes hele eller halve.
Knust tablet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Dosisjustering
- GFR: 0-30 ml/min.
- Alder: 2-17 år
- Vægt: <50 KG
- Dosis: >20 mg
Højst 20 mg pr. kg legemsvægt dgl.
- GFR: 30-50 ml/min.
- Alder: 2-17 år
- Vægt: <50 KG
- Dosis: >30 mg
Højst 30 mg pr. kg legemsvægt dgl.
- GFR: 50-80 ml/min.
- Alder: 2-17 år
- Vægt: <50 KG
- Dosis: >40 mg
Højst 40 mg pr. kg legemsvægt dgl.
- GFR: 0-30 ml/min.
- Alder: ≥17 år
- Dosis: >1000 mg
Højst 1.000 mg dgl.
Samme dosis til patienter i dialyse. Efter dialyse anbefales 250 mg til 500 mg som supplerende dosis.
- GFR: 30-50 ml/min.
- Alder: ≥17 år
- Dosis: >1500 mg
Højst 1.500 mg dgl.
- GFR: 50-80 ml/min.
- Alder: ≥17 år
- Dosis: >2000 mg
Højst 2.000 mg dgl.
- GFR: 0-30 ml/min.
- Alder: 12-17 år
- Vægt: ≥50 KG
- Dosis: >1000 mg
Højst 1.000 mg dgl.
Samme dosis til patienter i dialyse. Efter dialyse anbefales 250 mg til 500 mg som supplerende dosis.
- GFR: 30-50 ml/min.
- Alder: 12-17 år
- Vægt: ≥50 KG
- Dosis: >1500 mg
Højst 1.500 mg dgl.
- GFR: 50-80 ml/min.
- Alder: 12-17 år
- Vægt: ≥50 KG
- Dosis: >2000 mg
Højst 2.000 mg dgl.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Seponering
Seponering bør foretages gradvis over 2-4 uger.
Eksempelvis:
- For voksne og unge (> 50 kg) reduktion med 500 mg to gange dagligt hver anden til fjerde uge
- Hos spædbørn (> 6 mdr.) samt børn og unge (< 50 kg) bør dosis ikke reduceres med mere end 10 mg/kg to gange dagligt hver anden uge
- For spædbørn (< 6 mdr.) bør dosis ikke reduceres med mere end 7 mg/kg to gange dagligt hver anden uge.
Forsigtighedsregler
- Behandling med antiepileptika er forbundet med en let øget risiko for suicidaltanker eller -adfærd.
- Forsigtighed ved tidligere overfølsomhed over for andre antiepileptika med lignende struktur, fx brivaracetam.
- Levetiracetam kan i sjældne tilfælde forværre krampeanfaldshyppighed eller -sværhedsgrad, særligt inden for den første måned af behandlingen eller ved dosisoptrapning, og er reversibel ved seponering af lægemidlet eller dosisreduktion. Patienten bør rådes til at konsultere lægen i tilfælde af forværring af epilepsi.
- Forlænget QT-interval på ekg er observeret under overvågning efter markedsføringen. Levetiracetam skal anvendes med forsigtighed hos patienter med forlænget QT- interval, hos patienter, der samtidig behandles med lægemidler, der påvirker QT-intervallet, eller hos patienter med relevant forudeksisterende hjertesygdom eller elektrolytforstyrrelser.
- Manglende virkning eller forværring af anfald er fx blevet rapporteret hos patienter med epilepsi forbundet med mutationer i den spændingsstyrede natriumkanal alfa-subunit 8 (SCN8A).
Bivirkninger
Kliniske manifestationer af multiorgan-overfølesesreaktioner (DRESS) kan udvikle sig 2 til 8 uger efter behandlingsstart. Disse forekommer typisk med feber, udslæt, ansigtsødem, lyfmadenopatier, hæmatologiske abnormiteter og kan være forbundet med involvering af forskellige organsystemer, hovedsagelig leveren. Ved mistanke om DRESS bør levetiracetam seponeres.
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Nervesystemet | Hovedpine | |
| Psykiske forstyrrelser | Døsighed | |
| Luftveje, thorax og mediastinum | Rhinitis | |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Dyspepsi, Kvalme, Opkastning |
| Almene symptomer og reaktioner på administrationsstedet | Balanceforstyrrelser, Letargi | Kraftesløshed, Træthed |
| Metabolisme og ernæring | Nedsat appetit | |
| Knogler, led, muskler og bindevæv | Kramper | |
| Nervesystemet | Svimmelhed, Tremor | |
| Psykiske forstyrrelser | Aggressivitet, Depression, Nervøsitet | Irritabilitet, Søvnløshed |
| Luftveje, thorax og mediastinum | Hoste | |
| Hud og subkutane væv | Hududslæt | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Leukopeni, Trombocytopeni | |
| Øjne | Dobbeltsyn, Sløret syn | |
| Lever og galdeveje | Leverpåvirkning | |
| Nervesystemet | Ataksi, Hukommelsesbesvær, Koordinationsbesvær, Paræstesier | |
| Psykiske forstyrrelser | Agitation, Humørforstyrrelser, Koncentrationsbesvær, Psykose, Suicidaladfærd | |
| Sjældne (0,01-0,1 %) | ||
| Blod og lymfesystem | Agranulocytose, Pancytopeni | |
| Mave-tarm-kanalen | Pancreatitis | |
| Almene symptomer og reaktioner på administrationsstedet | Malignt neuroleptikasyndrom** | |
| Immunsystemet | Anafylaktisk reaktion, Angioødem, Stevens-Johnsons syndrom | |
| Infektioner og parasitære sygdomme | Infektioner | |
| Undersøgelser | Forlænget QT-interval | Forhøjet plasma-kreatinkinase |
| Metabolisme og ernæring | Hyponatriæmi | |
| Knogler, led, muskler og bindevæv | Rhabdomyolyse | |
| Nervesystemet | Choreiforme bevægelser, Dyskinesier, Encefalopati*, Gangforstyrrelser | |
| Psykiske forstyrrelser | Delirium, Personlighedsændringer, Tankeforstyrrelser | |
| Nyrer og urinveje | Akut nefropati | |
| Hud og subkutane væv | Erythema multiforme, Lægemiddelreaktion med eosinofili og systemiske symptomer - DRESS, Toksisk epidermal nekrolyse (TEN) | |
| Meget sjældne (< 0,01 %) | ||
| Psykiske forstyrrelser | Tvangshandlinger*** | |
* Tilfælde af encefalopati forekommer generelt i begyndelsen af behandlingen (fra få dage til flere måneder) og er reversible efter seponering af behandlingen.
** Forekomsten er betydeligt højere hos patienter af japansk afstamning.
***I meget sjældne tilfælde er udvikling af obsessiv-kompulsiv lidelse (OCD) hos patienter med underliggende anamnese med OCD eller psykiske forstyrrelser blevet observeret efter markedsføring.
Kliniske aspekter
Bivirkningsprofilen for levetiracetam er generelt den samme på tværs af aldersgruppe og for alle godkendte epilepsi-indikationer.
Interaktioner
- Der er rapporteret øget plasmakoncentration af methotrexat ved samtidig administration af levetiracetam.
- Andre antiepileptika og MAO-hæmmere kan forstærke levetiracetams depressive effekt.
Graviditet
Baggrund: Der er data for mere end 2.000 1. trimester-eksponerede i monoterapi uden tegn på overhyppighed af misdannelser. Ved kombination med andre antiepileptika (ca. 1.000 1. trimester-eksponerede) synes risikoen at være øget til ca. 6 %. Behandlingen skal varetages af en speciallæge i neurologi.
Gravide i antiepileptisk behandling bør kontrolleres ca. 1 gang om måneden med måling af plasmakoncentration, idet levetiracetam har øget omsætningshastighed under graviditet.
Behandlingen af epilepsi hos gravide skal varetages i samarbejde med en speciallæge i neurologi.
Se endvidere Epilepsi hos voksne.
Evt. indhold af benzylalkohol
Levetiracetam oral opløsning fra "Aristo Pharma" indeholder benzylalkohol der kræver forsigtighed ved brug af høje doser til gravide og ammende. Læs mere her.
Amning
Ammede børn har meget lave og i det fleste tilfælde umålelige koncentrationer i blodet. Anvendelse bør dog ledsages af øget opmærksomhed på mulige irritative eller sedative bivirkninger hos det ammede barn.
Evt. indhold af benzylalkohol
Levetiracetam oral opløsning fra "Aristo Pharma" indeholder benzylalkohol der kræver forsigtighed ved brug af høje doser til gravide og ammende. Læs mere her.
Bloddonor
Alkohol
Alkohol og Levetiracetam "1A Farma" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Forgiftning
Se Levetiracetam.
Farmakodynamik
Virkemåden i CNS er ikke endeligt afklaret.
Farmakokinetik
- Biotilgængelighed tæt på 100 %.
- Maksimal plasmakoncentration efter 20-120 minutter.
- Steady state efter ca. 2 døgn.
- Metaboliseres delvist i vævene til inaktive metabolitter.
- Plasmahalveringstid 6-8 timer, hos ældre 10-11 timer.
- Ca. 66 % udskilles uomdannet gennem nyrerne.
Se endvidere Tabel 1 i Antiepileptika.
Egenskaber, håndtering og holdbarhed
Holdbarhed
- Efter åbning: Kan opbevares i højst 100 dage.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 250 mg |
Farve
Andre
|
|
| 500 mg |
Farve
Andre
|
||
| 750 mg |
Farve
Andre
|
||
| 1000 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | filmovertrukne tabletter
250 mg
Levetiracetam "1A Farma" |
108611 |
50 stk. (blister)
|
Udgået 28-04-2025 | |||
| (B) | filmovertrukne tabletter
250 mg
Levetiracetam "1A Farma" |
082653 |
100 stk. (blister)
|
177,10 | 1,77 | 10,63 | |
| (B) | filmovertrukne tabletter
500 mg
Levetiracetam "1A Farma" |
556988 |
100 stk. (blister)
|
214,70 | 2,15 | 6,44 | |
| (B) | filmovertrukne tabletter
500 mg
Levetiracetam "1A Farma" |
435148 |
200 stk. (blister)
|
262,60 | 1,31 | 3,94 | |
| (B) | filmovertrukne tabletter
750 mg
Levetiracetam "1A Farma" |
168581 |
100 stk. (blister)
|
280,75 | 2,81 | 5,62 | |
| (B) | filmovertrukne tabletter
1000 mg
Levetiracetam "1A Farma" |
434073 |
100 stk. (blister)
|
410,25 | 4,10 | 6,15 | |
| (B) | filmovertrukne tabletter
1000 mg
Levetiracetam "1A Farma" |
451770 |
200 stk. (blister)
|
588,15 | 2,94 | 4,41 |
Substitution
| filmovertrukne tabletter 250 mg |
|---|
| Keppra UCB Nordic, Levetiracetam, filmovertrukne tabletter 250 mg |
| Levetiracetam "Accord" Accord, Levetiracetam, filmovertrukne tabletter 250 mg |
| Levetiracetam "Krka" KRKA, Levetiracetam, filmovertrukne tabletter 250 mg |
| Levetiracetam "Medical Valley" Medical Valley, Levetiracetam, filmovertrukne tabletter 250 mg |
| Levetiracetam "Orion" Orion Pharma, Levetiracetam, filmovertrukne tabletter 250 mg |
| filmovertrukne tabletter 500 mg |
|---|
| Keppra UCB Nordic, Levetiracetam, filmovertrukne tabletter 500 mg |
| Levetiracetam "Accord" Accord, Levetiracetam, filmovertrukne tabletter 500 mg |
| Levetiracetam "Krka" KRKA, Levetiracetam, filmovertrukne tabletter 500 mg |
| Levetiracetam "Medical Valley" Medical Valley, Levetiracetam, filmovertrukne tabletter 500 mg |
| filmovertrukne tabletter 750 mg |
|---|
| Levetiracetam "Accord" Accord, Levetiracetam, filmovertrukne tabletter 750 mg |
| Levetiracetam "Orion" Orion Pharma, Levetiracetam, filmovertrukne tabletter 750 mg |
| filmovertrukne tabletter 1000 mg |
|---|
| Keppra UCB Nordic, Levetiracetam, filmovertrukne tabletter 1000 mg |
| Levetiracetam "Accord" Accord, Levetiracetam, filmovertrukne tabletter 1000 mg |
| Levetiracetam "Medical Valley" Medical Valley, Levetiracetam, filmovertrukne tabletter 1000 mg |
Foto og identifikation
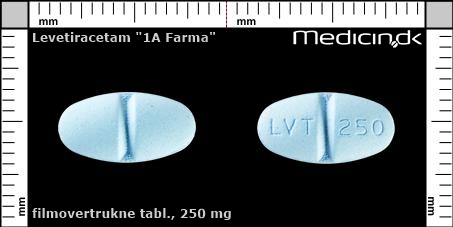
Filmovertrukne tabletter 250 mg |
| Præg: |
LVT, 250
|
| Kærv: | Delekærv |
| Farve: | Lyseblå |
| Mål i mm: | 7 x 13 |
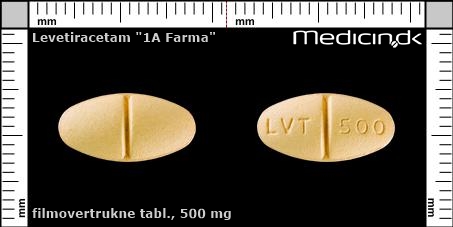
Filmovertrukne tabletter 500 mg |
| Præg: |
LVT, 500
|
| Kærv: | Delekærv |
| Farve: | Gul |
| Mål i mm: | 8 x 15 |
Filmovertrukne tabletter 750 mg |
| Præg: |
LVT, 750
|
| Kærv: | Delekærv |
| Farve: | Orange |
| Mål i mm: | 10 x 18 |

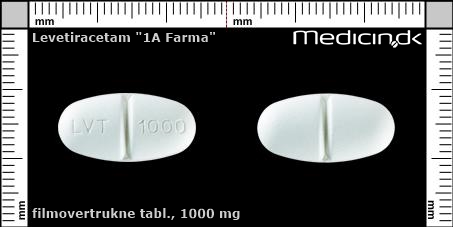
Filmovertrukne tabletter 1000 mg |
| Præg: |
LVT, 1000
|
| Kærv: | Delekærv |
| Farve: | Hvid |
| Mål i mm: | 10 x 20 |
Referencer
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
5203. Angela K. Birnbaum, Kimford J. Meador, Ashwin Karanam. Antiepileptic Drug Exposure in Infants of Breastfeeding Mothers With Epilepsy. JAMA. 2019; 77(4):441-50, https://jamanetwork.com/journals/jamaneurology/article-abstract/2758017 (Lokaliseret 19. oktober 2023)
4137. Vajda FJE, Graham JE, Hitchcock AA et al. Antiepileptic drugs and foetal malformation: analysis of 20 years of data in a pregnancy register. Seizure. 2018; 65:6-11, https://www.ncbi.nlm.nih.gov/pubmed/30593875 (Lokaliseret 24. februar 2022)
4138. Tomson T, Battino D, Bonizzoni E et al. Comparative risk of major congenital malformations with eight different antiepileptic drugs: a prospective cohort study of the EURAP registry. Lancet Neurol. 2018; 17(6):530-8, https://www.ncbi.nlm.nih.gov/pubmed/29680205 (Lokaliseret 24. februar 2022)
4142. Weston J, Bromley R, Jackson CF et al. Monotherapy treatment of epilepsy in pregnancy: congenital malformation outcomes in the child. Cochrane Database Syst Rev. 2016; 11, https://www.ncbi.nlm.nih.gov/pubmed/27819746 (Lokaliseret 24. februar 2022)
4211. Veiby G, Daltveit AK, Engelsen BA et al. Fetal growth restriction and birth defects with newer and older antiepileptic drugs during pregnancy. J Neurol. 2014; 261:579-88, https://www.ncbi.nlm.nih.gov/pubmed/24449062 (Lokaliseret 24. februar 2022)
4225. Chaudhry SA, Jong G, Koren G. The fetal safety of Levetiracetam: a systematic review. Reprod Toxicol. 2014; 46:40-5, https://www.ncbi.nlm.nih.gov/pubmed/24602560 (Lokaliseret 24. februar 2022)



