Generel information
Middel mod transthyretin amyloidose (ATTR).
Anvendelsesområder
20 mg kapsler
- Transthyretin amyloidose (ATTR) hos voksne med polyneuropati i stadie 1.
61 mg kapsler
- Transthyretin amyloidose (ATTR) hos voksne med kardiomyopati.
Behandlingen bør forestås af læger med særligt kendskab til amyloidose.
Medicinrådet har lavet en vurdering af præparatet.
Dispenseringsform
Kapsler, bløde. 1 kapsel indeholder 20 mg tafamidis (som tafamidismeglumin) eller 61 mg tafamidis (mikroniseret).
Doseringsforslag
Ved polyneuropati
- Voksne. 20 mg 1 gang dgl.
Ved kardiomyopati
- Voksne. 61 mg 1 gang dgl.
- Begrænset erfaring vedr. patienter i NYHA-klasse IV.
Bemærk:
- Kapslerne synkes hele med et glas vand.
- Kapslerne må ikke åbnes.
- Kan tages med eller uden mad
- Tafamidis og tafamidismeglumin er ikke indbyrdes ombyttelige på mg-basis.
- Begrænset erfaring vedr. ældre over 65 år. Er ikke indiceret til børn.
Håndtering af kapsler og tabletter
| bløde kapsler 20 mg, Pfizer |
| bløde kapsler 61 mg, Pfizer |
Mad og drikke
Kan tages med eller uden mad.
Knusning/åbning
Må ikke åbnes.
Administration
Synkes hele med et glas vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Forsigtighed, ingen eller begrænset erfaring
GFR: 0-30 ml/min.
Begrænset erfaring ved svært nedsat nyrefunktion.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Forsigtighedsregler
Forsigtighed ved stærkt nedsat leverfunktion. Seponeres ved levertransplantation pga. manglende erfaring.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter* | Diarré |
| Nyrer og urinveje | Urinvejsinfektion* | |
| Almindelige (1-10 %) | ||
| Hud og subkutane væv | Hudkløe**, Hududslæt** | |
* Kun set ved behandling med 20 mg tafamidis dgl.
** Kun set ved behandling med 61 mg tafamidis dgl.
Kliniske aspekter
I de kliniske studier var de hyppigste bivirkninger diarré (26.3%), urinvejsinfektion (25,5 %) og influenza (21,2 %) og efterfølgende indberetninger af bivirkninger har ikke vist markant anderledes bivirkningsprofil (6263).
Interaktioner
Tafamidis hæmmer brystcancer-resistensprotein (BCRP) og transportstofferne OAT1 og OAT3. Der er mulighed for interaktion med substrater for disse stoffer (fx methotrexat, rosuvastatin, imatinib, NSAID, bumetanid, furosamid, lamivudin, oseltamivir, tenofovir, ganciclovir, adefovir, zidovudin).
Graviditet
Baggrund: Der er ikke humane data, som tillader et meningsfyldt risikoestimat.
Se også Klassifikation - graviditet
Fertile kvinder og mænd
Fertile kvinder
Ved behandling af kvinder i den fertile alder skal der anvendes sikker kontraception under behandlingen og i 1 måned efter behandlingens ophør på grund af lægemidlets lange halveringstid. Denne anbefaling er baseret på en teoretisk vurdering af det aktive stofs egenskaber.
Amning
Baggrund: Der er ingen kvantitative data for udskillelse i modermælk.
Bloddonor
Alkohol
Alkohol og Vyndaqel påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Binder sig til den naturlige tetrameriske form af transthyretin og forhindrer dannelsen af monomerer, hvilket nedsætter sygdomsprogressionen.
Farmakokinetik
- Den relative biotilgængelighed er ens for 61 mg tafamidis og 80 mg tafamidismeglumin ved steady state, men tafamidis og tafimidsmeglumin er ikke indbyrdes ombyttelige på mg-basis.
- Maksimal plasmakoncentration efter ca. 2 timer for tafamidismeglumin og ca. 4 timer for tafamidis.
- Plasmahalveringstiden er ca. 49 timer, hvorfor steady state opnås efter ca. 14 dage.
- Udskilles overvejende med fæces.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| bløde kapsler | 20 mg |
Farve
Andre
Antioxidanter
|
|
| 61 mg |
Farve
Andre
Antioxidanter
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | bløde kapsler
20 mg
Vyndaqel |
541372 |
30 stk. (blister)
|
87.790,00 | 2.926,33 | 2.926,33 | |
| (BEGR) | bløde kapsler
61 mg
Vyndaqel |
144490 |
30 stk. (blister)
|
76.642,35 | 2.554,75 | 837,62 |
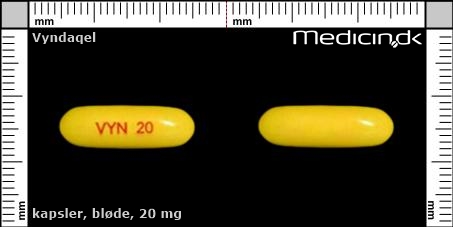
Foto og identifikation
Bløde kapsler 20 mg |
| Præg: |
VYN, 20
|
| Kærv: | Ikke relevant |
| Farve: | Gul |
| Mål i mm: | 6 x 21 |
Bløde kapsler 61 mg |
| Præg: |
VYN, 61
|
| Kærv: | Ikke relevant |
| Farve: | Rødbrun |
| Mål i mm: | 7,5 x 21 |

Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
6263. Huber P, Flynn A, Sultan MB et al. A comprehensive safety profile of tafamidis in patients with transthyretin amyloid polyneuropathy. Amyloid. 2019; 26(4):203-9, https://pubmed.ncbi.nlm.nih.gov/31353964/ (Lokaliseret 23. juli 2024)
1550. SPC, Lægemiddelstyrelsen. , http://www.produktresume.dk (Lokaliseret 17. marts 2023)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)
3966. SPC, EMA. European Medicines Agency. , https://www.ema.europa.eu/en/medicines (Lokaliseret 6. februar 2024)



