Generel information
Kolinesterasehæmmer. Middel til behandling af demens. Tertiær alkaloid.
Anvendelsesområder
Anvendes ved Alzheimers sygdom, Lewy Body demens og demens ved Parkinsons sygdom, alle i let til svær grad. Se endvidere Demens.
Dispenseringsform
Depotkapsler, hårde. 1 depotkapsel indeholder 8 mg, 16 mg eller 24 mg galantamin (som hydrobromid).
Doseringsforslag
Voksne. Initialt 8 mg om morgenen i forbindelse med et måltid. Efter 4 ugers behandling kan dosis øges til 16 mg dgl., og evt. efter yderligere 4 ugers behandling til 24 mg dgl.
Bemærk:
- Depotkapslerne synkes hele med et glas vand.
- Kan tages med eller uden mad.
- Depotkapslerne kan åbnes.
- Indholdet kan kommes på blød mad, fx yoghurt eller æblemos.
- Indholdet må ikke tygges eller knuses.
- Patienten bør som hovedregel have en omsorgsperson (kan være fra hjemmeplejen), som hjælper med at håndtere medicineringen.
Håndtering af kapsler og tabletter
| hårde depotkapsler 8 mg, STADA Nordic |
| hårde depotkapsler 16 mg, STADA Nordic |
| hårde depotkapsler 24 mg, STADA Nordic |
Mad og drikke
Kan tages med eller uden mad.
Indholdet kan kommes på blød mad, fx yoghurt eller æblemos.
Knusning/åbning
Kan åbnes.
Administration
Synkes hele med et glas vand.
Indholdet må ikke tygges eller knuses.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Kontraindiceret, erfaring savnes
GFR: 0-10 ml/min.
Erfaring savnes.
Mulige alternativer, se Midler mod demens.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
- Child-Pugh 7-9. Dosisintervallet bør initialt nedsættes til 8 mg hver 2. dag i 1 uge. Derefter 8 mg dgl. i 4 uger. Maksimal døgndosis 16 mg.
- Child-Pugh > 9. Kontraindiceret pga. manglende erfaring.
Forsigtighedsregler
Bradykardi
Forsigtighed ved syg sinusknude-syndrom eller andre supraventrikulære overledningsforstyrrelser i hjertet. Galantamin kan have vagotonisk virkning på hjertefrekvensen og kan medføre bradykardi og AV-blok.
Mavesår
Kolinerge midler kan øge syresekretionen i ventriklen og derved øge risikoen for forværring af ulcus.
Monitorering af vægt
Patientens vægt bør følges, da behandling med kolinesterasehæmmere kan øge risikoen for vægttab.
Obstruktive lungesygdomme
Galantamin har en kolinerg effekt. Forsigtighed ved astma eller kronisk obstruktiv lungesygdom.
Risiko for forlænget QT-interval
Forlænget QT-interval er forekommet og udvikling af torsades de pointes er set ved overdosering. Forsigtighed ved medfødt langt QT-interval eller anden eksisterende QT-forlængelse.
Risiko for kramper
Udvikling af kramper er set under behandling med galantamin. Forsigtighed ved nedsat krampetærskel.
Risiko for udvikling af alvorlige hudreaktioner
Der er forekommet alvorlige hudreaktioner som fx Stevens-Johnsons syndrom ved behandling med galantamin. Ved symptomer på alvorlige hudreaktioner bør behandlingen seponeres.
Urinvejsobstruktion
Kolinerge midler kan medføre blæreobstruktion. Opmærksomhed på mulig forværring af tilstanden ved urinvejsobstruktion.
Typiske alvorlige fejl
| Beskrivelse | Konsekvens |
|---|---|
| For høj initialdosis. Der blev fejlagtigt ordineret 8 mg x 2 i stedet for 8 mg x 1. | Forværring af atrieflimren. |
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Kvalme, Opkastning | |
| Almindelige (1-10 %) | ||
| Hjerte | Bradykardi | |
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Dyspepsi |
| Almene symptomer og reaktioner på administrationsstedet | Kraftesløshed, Træthed | |
| Undersøgelser | Vægttab | |
| Metabolisme og ernæring | Nedsat appetit | |
| Knogler, led, muskler og bindevæv | Muskelkramper | |
| Nervesystemet | Svimmelhed, Tremor | Hovedpine |
| Psykiske forstyrrelser | Depression, Hallucinationer, Somnolens | |
| Luftveje, thorax og mediastinum | Rhinitis | |
| Vaskulære sygdomme | Hypertension, Synkope | |
| Ikke almindelige (0,1-1 %) | ||
| Hjerte | AV-blok, Supraventrikulær ekstrasystoli | Palpitationer |
| Øre og labyrint | Tinnitus | |
| Øjne | Sløret syn | |
| Mave-tarm-kanalen | Smagsforstyrrelser | |
| Immunsystemet | Allergiske reaktioner | |
| Undersøgelser | Forhøjede leverenzymer* | |
| Metabolisme og ernæring | Dehydrering | |
| Knogler, led, muskler og bindevæv | Muskelsvaghed | |
| Nervesystemet | Ekstrapyramidale gener, Paræstesier | |
| Hud og subkutane væv | Øget svedtendens | |
| Vaskulære sygdomme | Hypotension | |
| Sjældne (0,01-0,1 %) | ||
| Lever og galdeveje | Hepatitis | |
| Ikke kendt hyppighed | ||
| Immunsystemet | Stevens-Johnsons syndrom | |
| Hud og subkutane væv | Akut generaliseret eksantematøs pustulose (AGEP), Erythema multiforme | |
* Seponering bør overvejes ved leverinsufficiens uden anden kendt årsag.
Kliniske aspekter
- De fleste patienter tåler behandlingen godt uden nævneværdige bivirkninger. På trods af dette vil ca. 10 %, der tager kolinesterasehæmmerne, ophører på grund af bivirkninger.
- I praksis ses der flest GI- bivirkninger (særligt kvalme og diarré), der oftest forekommer ifm. behandlingsopstart og evt. dosisøgning og svinder efter nogle dage. Indtag med mad kan modvirke kvalme. Dosering til natten kan evt. forsøges, da patienten i så tilfælde sover mens bivirkninger som kvalme er værst.
- Nedsat appetit, medførende vægttab, er også en hyppigt forekommende bivirkning.
Det er vigtigt at være opmærksom på evt. vægttab, da det ofte ikke rapporteres eller opfattes af patienten og da pårørende heller ikke altid er opmærksomme på dette, eller forbinder det med bivirkninger. Ved mistanke om vægttab bør patientens vægt monitoreres og fx ernæringstilskud kan overvejes.
Støtte og rådgivning under optrapning er afgørende for at ungå problematisk vægttab, men seponering eller præparatskift til plasterbehandling kan være nødvendig. - Søvnløshed og abnorme drømme vil normalt også mindskes ved fortsat behandling, men kan ellers modvirkes ved dosering om morgenen. Man bør være opmærksom på, at grundsygdommen i sig selv kan medføre søvnforstyrrelser. Det er ikke altid, at patienterne oplever de livlige drømme som problematiske.
- Pga. stimulering af mavesyreudskillelsen, kan der forekomme GI-blødning og -ulcerationer. Behandling med en PPI kan overvejes i disse tilfælde.
- Risikoen for bradykardi og synkope kan øges ved samtidig behandling med midler, der kan sænke hjerterytmen som fx betablokkere og visse antiarytmika. Forsigtighed ved overledningsforstyrrelser som 1. grads AV-blok eller andre blok.
- Nogle patienter oplever rhinnorré af behandlingen, som kan være irriterende.
- Præparatskift kan forsøges ved bivirkninger, men der er ikke evidens for, at bivirkningsprofilen er forskellig imellem de forskellige kolinesterasehæmmere. Ved GI-bivirkninger, kan plasterbehandling overvejes.
- Skrøbelige patienter (fx grundet lav vægt, demenssygdommen eller andre komorbiditeter) har en højere risiko for bivirkninger. Øget forekomst af bivirkninger kan fx ses ved nedsat lever- eller nyrefunktion samt ved legemsvægt under 50 kg.
- Patienter med demens har ofte nedsat egenomsorg og reduceret sygdomsindsigt. Derfor bør der udspørges om specifikke bivirkninger, og altid forsøges at skaffe oplysninger fra pårørende også. Hvis det er muligt med andre midler at overvåge bivirkninger (fx vejning) bør dette anvendes.
Interaktioner
- På grund af de farmakodynamiske virkninger bør galantamin ikke gives samtidig med andre lægemidler med kolinerg virkning.
- Plasmakoncentrationen af galantamin øges ved samtidig indgift af paroxetin (ca. 40 %) og fluoxetin, begge hæmmere af CYP2D6, samt erythromycin (ca. 12 %), hæmmer af CYP3A4. Lignende effekt kan forventes ved andre CYP2D6- og CYP3A4-hæmmere. Se tabel 2 i Elimination og cytokrom P450-systemet.
- Galantamin kan forstærke virkningen af depolariserende muskelrelaksantia.
Graviditet
Der foreligger ikke kliniske data om eksponering for galantamin under graviditet. Den potentielle risiko for mennesker er ukendt.
Amning
Ikke indiceret til ammende. Det vides ikke, om galantamin udskilles i human mælk.
Bloddonor
Alkohol
Alkohol og Galantamin "Stada" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Forgiftning
Kolinergt toksidrom.
Behandling: Massiv overdosering kan behandles med atropin, evt. gentaget afhængig af effekt.
Bemærk: Ved snævervinklet glaukom skal øjnene dryppes med pilocarpin 2 % samtidig med injektion af atropin.
Farmakodynamik
Selektiv, kompetitiv og reversibel hæmmer af acetylkolinesterase. Virker desuden ved at modulere præsynaptiske nicotinreceptorer medførende en øget aktivitet i det kolinerge system. Virker overvejende centralt. Forbedrer kognitive funktioner samt patientens samlede (globale) funktion. Forhindrer ikke sygdomsprogressionen, men forsinker symptomudviklingen.
Farmakokinetik
- Biotilgængelighed ca. 90 %.
- Maksimal plasmakoncentration efter ca. 4 timer.
- Metaboliseres i leveren via CYP3A4 og CYP2D6 til delvis aktive metabolitter.
- Plasmahalveringstid 7-8 timer.
- Ca. 20 % udskilles uomdannet gennem nyrerne,
- Depotkapslerne (polydepot) frigiver det aktive stof over et længere tidsrum.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| hårde depotkapsler | 8 mg |
Farve
Andre
|
|
| 16 mg |
Farve
Andre
|
||
| 24 mg |
Farve
Andre
|
Firma
Tilskud
Enkelttilskud vil normalt kunne gives, når følgende betingelser er opfyldt og fremgår af ansøgningen:
- Patienten har Alzheimers demens, Lewy Body demens eller demens som led i Parkinsons sygdom.
- Diagnosen er stillet af en speciallæge i psykiatri, neurologi og/eller geriatri
- Andre demenssygdomme (specielt reversible demenstilstande) er udelukkede, bl.a. ved CT-scanning.
- Patienten på grund af bivirkninger eller af anden grund ikke kan anvende anden kolinesterasehæmmer.
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (A) | hårde depotkapsler
8 mg
(PharmaCoDane)
(kan dosisdisp.)
Galantamin "Stada" |
564124 |
30 stk. (blister)
|
229,00 | 7,63 | 15,27 | |
| (A) | hårde depotkapsler
16 mg
(PharmaCoDane)
(kan dosisdisp.)
Galantamin "Stada" |
118379 |
30 stk. (blister)
|
371,45 | 12,38 | 12,38 | |
| (A) | hårde depotkapsler
24 mg
(PharmaCoDane)
(kan dosisdisp.)
Galantamin "Stada" |
469931 |
30 stk. (blister)
|
161,65 | 5,39 | 3,59 | |
| (A) | hårde depotkapsler
24 mg
(PharmaCoDane)
(kan dosisdisp.)
Galantamin "Stada" |
389404 |
84 stk. (blister)
|
371,45 | 4,42 | 2,95 |
Substitution
| hårde depotkapsler 8 mg |
|---|
| Galantamin "Krka" KRKA, Galantamin, hårde depotkapsler 8 mg |
| Galantamin "Nordic Prime" (Parallelimport), Galantamin, hårde depotkapsler 8 mg |
| hårde depotkapsler 16 mg |
|---|
| Galantamin "Krka" KRKA, Galantamin, hårde depotkapsler 16 mg |
| Galantamin "Nordic Prime" (Parallelimport), Galantamin, hårde depotkapsler 16 mg |
| Galantamin Carefarm (Parallelimport), Galantamin, hårde depotkapsler 16 mg |
| hårde depotkapsler 24 mg |
|---|
| Galantamin "Krka" KRKA, Galantamin, hårde depotkapsler 24 mg |
Foto og identifikation
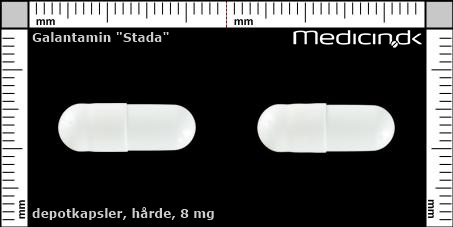
Hårde depotkapsler 8 mg |
| Præg: |
Intet præg
|
| Kærv: | Ikke relevant |
| Farve: | Hvid |
| Mål i mm: | 6,2 x 17,5 |
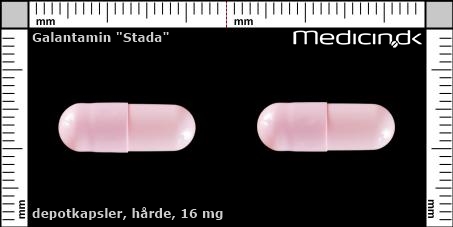
Hårde depotkapsler 16 mg |
| Præg: |
Intet præg
|
| Kærv: | Ikke relevant |
| Farve: | Lyserød |
| Mål i mm: | 6,2 x 17,5 |
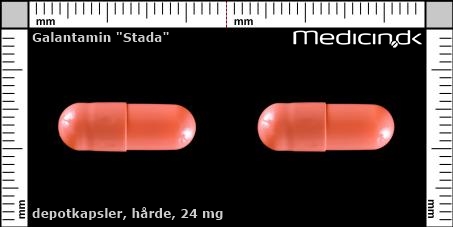
Hårde depotkapsler 24 mg |
| Præg: |
Intet præg
|
| Kærv: | Ikke relevant |
| Farve: | Orange |
| Mål i mm: | 6,2 x 17,5 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



