Generel information
Middel mod narkolepsi.
Anvendelsesområder
Narkolepsi med eller uden katapleksi.
Bemærk:
Modafinil bør kun anvendes, når behandlingen forestås af læger med særligt kendskab til narkolepsi. Behandlingen centreres til afdelinger med mulighed for udførelse af polygrafisk søvnregistrering til såvel diagnosticering som til opfølgning af behandlingseffekt.
Dispenseringsform
Tabletter. 1 tablet indeholder 100 mg modafinil.
Doseringsforslag
Voksne.
Initialt. 200 mg dgl. stigende til højst 400 mg dgl. Gives som 1 dosis om morgenen eller fordelt på 2 doser, morgen og middag.
Ældre over 65 år.
Initialt 100 mg.
Bemærk:
- Tabletterne tages med et glas vand.
- Tabletterne kan knuses.
- Knust tablet kan opslæmmes i vand.
- Knust tablet kan kommes på kold, blød mad.
- Kan tages med eller uden mad.
- Må ikke anvendes til børn og unge under 18 år. Tilfælde af alvorlige hudreaktioner (herunder Stevens-Johnsons syndrom) er forekommet og sikkerhed og virkning er ikke klarlagt i kontrollerede studier.
Håndtering af kapsler og tabletter
| tabletter 100 mg, Orion Pharma Ingen kærv |
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Knust tablet kan kommes på kold, blød mad.
Knusning/åbning
Kan knuses.
Administration
Knust tablet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat leverfunktion
Kontraindikationer
- Ukontrolleret moderat-svær hypertension.
- Arytmier.
Forsigtighedsregler
- Bør ikke anvendes ved:
- Tidligere ventrikelhypertrofi eller cor pulmonale.
- Mitralprolaps eller tidligere mitralprolaps ved behandling med CNS-stimulerende midler.
- Ekg bør tages før behandlingen indledes ved mistanke om hjertesygdom.
- Blodtryk og puls bør jævnligt kontrolleres.
- Patienter med alvorlige angsttilstande bør kun behandles i samarbejde med speciallæge i psykiatri.
- Brug ved hypersomni på grund af obstruktiv søvnapnø bør kun ske, efter anden relevant behandling er indledt.
- Forsigtighed ved tidligere psykiske lidelser som psykoser, depression eller mani samt ved tidligere misbrug.
- Der bør regelmæssigt (og ved dosisændringer) monitoreres for nyopståede psykiske lidelser eller forværring af eksisterende lidelser, herunder selvmordsrelateret adfærd.
- Alvorlige hudreaktioner er forekommet - oftest 1-5 uger efter behandlingsstart. Seponeres ved tegn på hududslæt.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Nervesystemet | Hovedpine | |
| Almindelige (1-10 %) | ||
| Hjerte | Palpitationer, Takykardi | |
| Øjne | Sløret syn | |
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Dyspepsi, Kvalme, Mundtørhed, Obstipation |
| Almene symptomer og reaktioner på administrationsstedet | Kraftesløshed | |
| Undersøgelser | Forhøjede leverenzymer | |
| Metabolisme og ernæring | Nedsat appetit | |
| Nervesystemet | Paræstesier, Svimmelhed | |
| Psykiske forstyrrelser | Angst, Depression, Konfusion, Nervøsitet, Tankeforstyrrelser | Døsighed, Irritabilitet, Søvnløshed |
| Det reproduktive system og mammae | Brystsmerter | |
| Vaskulære sygdomme | Vasodilatation | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Eosinofili, Leukopeni | |
| Hjerte | Arytmier, Bradykardi, Ventrikulær ekstrasystoli | |
| Øjne | Synsforstyrrelser | Øjentørhed |
| Mave-tarm-kanalen | Flatulens, Gastro-øsofageal refluks, Glossitis, Opkastning, Orale ulcera, Smagsforstyrrelser, Synkebesvær | |
| Immunsystemet | Allergiske reaktioner | |
| Undersøgelser | Ekg-forandringer | Vægttab, Vægtøgning |
| Metabolisme og ernæring | Diabetes, Hyperglykæmi, Hyperkolesterolæmi | Tørst, Øget appetit |
| Knogler, led, muskler og bindevæv | Artralgi, Benkramper, Muskelkramper, Rygsmerter, Øget muskeltonus | Myalgi, Nakkesmerter |
| Nervesystemet | Bevægeforstyrrelser, CNS-stimulering, Dyskinesier, Hukommelsesbesvær, Hypæstesi, Koordinationsbesvær, Migræne, Myasteni, Tremor | |
| Psykiske forstyrrelser | Aggressivitet, Agitation, Depersonalisering, Humørforstyrrelser, Hyperaktivitet, Personlighedsændringer, Suicidaltanker, Talebesvær | Abnorme drømme, Søvnforstyrrelser |
| Nyrer og urinveje | Vandladningsbesvær | Unormal urin |
| Det reproduktive system og mammae | Menstruationsforstyrrelser, Nedsat libido | |
| Luftveje, thorax og mediastinum | Astma, Dyspnø | Epistaxis, Hoste, Pharyngitis, Rhinitis, Sinuitis |
| Hud og subkutane væv | Acne, Hudkløe, Hududslæt, Øget svedtendens | |
| Vaskulære sygdomme | Hypertension, Hypotension, Perifere ødemer | |
| Sjældne (0,01-0,1 %) | ||
| Psykiske forstyrrelser | Hallucinationer, Mani, Psykose | |
| Ikke kendt hyppighed | ||
| Immunsystemet | Anafylaktisk reaktion, Angioødem | |
| Hud og subkutane væv | Alvorlige hudreaktioner (herunder erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse og DRESS - lægemiddelreaktion med eosinofili og systemiske symptomer)* | |
* Forekom kun hos børn i kliniske studier, men er efterfølgende både indrapporteret hos børn og voksne.
Kliniske aspekter
- Hovedpine er den almindeligste bivirkning, forekommer hos ca. 21 %, er dosisafhængig og oftest mild til moderat og forbigående.
- Kvalme ses som en almindelig bivirkning og vil normalt svinde ved vedvarende behandling.
- Den CNS-stimulerende effekt kan medføre indsovningsbesvær, humørforandringer samt nervøsitet og rastløshed.
- Alvorlige hudreaktioner er set i sjældne tilfælde ved behandling med modafinil - oftest i de første 1-5 uger af behandlingen. Opmærksomhed på evt. hudreaktioner anbefales.
- Den stimulerende effekt på hjerte-karsystemet kan medføre bivirkninger som takykardi og blodtryksforhøjelse og regelmæssig kontrol anbefales.
- Som ved andre CNS-stimulerende stoffer har modafinil misbrugspotentiale, som bør overvåges.
Interaktioner
- På grund af modafinils induktion af CYP3A4 kan virkningen af kontraceptiva med østrogen-/gestagenindhold nedsættes. Anden eller supplerende kontraceptionsmetode anbefales.
- AUC for triazolam nedsættes ca. 60 % ved samtidig indgift af modafinil. Lignende effekt må forventes for andre midler, der omsættes via CYP3A4, se tabel 2 i Elimination og cytokrom P450-systemet.
- Risiko for nedsættelse af phenytoinclearance via modafenils hæmning af CYP2C9.
Graviditet
Baggrund: I juni 2019 er der af TEVA efter aftale med EMA (HPRA) udsendt en advarsel mod anvendelse af modafinil under graviditeten (4524). Analysen fra firmaets amerikanske graviditetsdatabase af 142 eksponerede, med kendt udfald af graviditeten, viste at 16 børn blev født med større misdannelser eller omkring 11 % sammenlignet med omkring 3-4 % i baggrundsbefolkningen. Opgørelse af Danske registerdata fandt 6 større misdannelser blandt 49 første trimester eksponerede - en klar forøget risiko i forhold til bagrundpopulationen (justeret Odds-Ratio 2,7; 95 % CI 1,1-6,9). Data fra Sverige og Norge fandt ingen tegn på en øget risiko for medfødte misdannelser (N=3) blandt i alt 133 første trimester eksponerede.
Se også Klassifikation - graviditet
Amning
Bloddonor
Doping

|
Anvendelse af Modafinil "Orion" medfører diskvalifikation af den sportsudøvende i konkurrencer. |
Alkohol
Alkohol og Modafinil "Orion" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Virkningsmekanismen ved narkolepsi er ikke klarlagt. Modafinil er en svag hæmmer af dopamins transportprotein (DAT) og virkningen skyldes muligvis en øgning af dopaminkoncentrationen i hjernen.
Farmakokinetik
- Absorberes næsten fuldstændigt fra mave-tarm-kanalen.
- Maksimal plasmakoncentration efter 2-4 timer.
- Metaboliseres i leveren til inaktive metabolitter.
- Plasmahalveringstid 10-12 timer.
- < 10 % udskilles uomdannet gennem nyrerne.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| tabletter | 100 mg |
Andre
|
Firma
Tilskud
Enkelttilskud vil normalt kunne imødekommes hvis:
- patienten har narkolepsi og
- patienten kan ikke tåle og/eller har ikke responderet tilstrækkeligt på billigere behandling med fx methylphenidat og
- behandlingen har vist effekt.
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | tabletter
100 mg
(kan dosisdisp.)
Modafinil "Orion" |
166117 |
30 stk. (blister)
|
86,55 | 2,89 | 8,66 | |
| (B) | tabletter
100 mg
(kan dosisdisp.)
Modafinil "Orion" |
545609 |
90 stk. (blister)
|
604,55 | 6,72 | 20,15 |
Substitution
| tabletter 100 mg |
|---|
| Modafinil "Orifarm" Orifarm Generics, Modafinil, tabletter 100 mg |
| Modiodal TEVA, Modafinil, tabletter 100 mg |
| Myldamo Viatris, Modafinil, tabletter 100 mg |
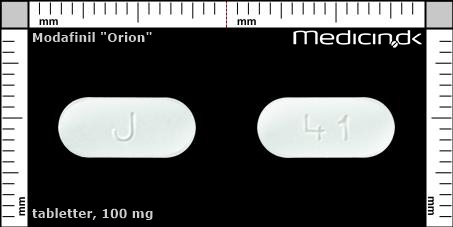
Foto og identifikation
Tabletter 100 mg |
| Præg: |
J, 41
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 5,5 x 12,6 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
4524. Modafinil - Important Safety Information from Teva Pharmaceuticals Ireland, Clonmel Healthcare Ltd and Fannin Limited as approved by HPRA. Health Products Regulatory Authority. 2019; 11/6, https://www.hpra.ie/homepage/medicines/safety-notices/item?t=/modafinil---important-safety-information-from-teva-pharmaceuticals-ireland-clonmel-healthcare-ltd-and-fannin-limited-as-approved-by-hpra&id=ad170c26-9782-6eee-9b55-ff00008c97d0 (Lokaliseret 3. marts 2022)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



