Generel information
Anvendelsesområder
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 10 mg, 20 mg eller 40 mg olmesartanmedoxomil.
Doseringsforslag
Voksne
- Initialt 10 mg 1 gang dgl. Dosis kan øges til 20 mg 1 gang dgl., maksimalt 40 mg dgl.
Børn 6 -18 år
- Initialt 10 mg dgl. Dosis kan øges til 20 mg dgl. Herefter til:
- Legemsvægt ≥ 35 kg: Maksimalt 40 mg dgl.
- Legemsvægt < 35 kg: Maksimalt 20 mg dgl.
Bemærk:
- Må ikke tygges.
- Bør ikke anvendes til børn < 1 år pga. manglende data.
- Der er ingen anbefaling vedr. dosering til børn 1-5 år. Foreliggende data kan ses i Produktresume.
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 10 mg, KRKA Ingen kærv |
| filmovertrukne tabletter 20 mg, KRKA Ingen kærv |
| filmovertrukne tabletter 40 mg, KRKA Ingen kærv |
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Knust tablet kan kommes på kold, blød mad.
Knusning/åbning
Kan knuses.
Administration
Synkes hele.
Knust tablet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Dosisjustering
- GFR: 0-40 ml/min.
- Alder: 6-17 år
- Vægt: <35 KG
- Dosis: >10 mg
Højst 10 mg dgl.
Rutinemæssig monitorering af P-kalium og nyrefunktion.
- GFR: 0-40 ml/min.
- Alder: ≥17 år
- Dosis: >20 mg
Initialdosis 10 mg. Højst 20 mg dgl.
Rutinemæssig monitorering af P-kalium og P-kreatinin.
- GFR: 0-40 ml/min.
- Alder: 6-17 år
- Vægt: ≥35 KG
- Dosis: >20 mg
Initialdosis 10 mg dgl. Højst 20 mg dgl.
Rutinemæssig monitorering af P-kalium og nyrefunktion.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
- Højst 20 mg dgl. ved moderat nedsat leverfunktion
- Bør ikke anvendes ved stærkt nedsat leverfunktion og/eller kolestase.
Kontraindikationer
- Biliær obstruktion
- Tidligere angioneurotisk ødem under behandling med angiotensin II-antagonister
- Samtidig behandling med aliskiren hos patienter med diabetes eller med nedsat nyrefunktion (GFR < 60 ml/min).
Forsigtighedsregler
- Angioødem i anamnesen
- Nyrearteriestenose
- Mitralklapstenose
- Aortastenose
- Hypertrofisk kardiomyopati.
- I forbindelse med de første doser er der hos enkelte patienter konstateret excessivt blodtryksfald, specielt ved samtidig behandling med diuretika og/eller andre vasodilatorer.
- Hypovolæmi bør korrigeres, før behandlingen indledes.
- Risiko for hyperkaliæmi ved samtidig indgift af aldosteronantagonister eller ACE-hæmmer.
- Der er indberettet intestinalt angioødem, med symptomer som mavesmerter, kvalme, opkastning og diare der forsvandt efter seponering af angiotensin II-receptorantagonister.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Dyspepsi, Gastroenteritis, Kvalme |
| Almene symptomer og reaktioner på administrationsstedet | Smerter | Træthed |
| Infektioner og parasitære sygdomme | Infektion i nedre luftveje | Influenzalignende symptomer |
| Undersøgelser | Forhøjet serum-urat | Forhøjede leverenzymer, Forhøjet plasma-carbamid, Forhøjet plasma-kreatinkinase |
| Metabolisme og ernæring | Hypertriglyceridæmi | |
| Knogler, led, muskler og bindevæv | Artritis, Knoglesmerter, Rygsmerter | |
| Nervesystemet | Svimmelhed | Hovedpine |
| Nyrer og urinveje | Hæmaturi, Urinvejsinfektion | |
| Luftveje, thorax og mediastinum | Hoste, Pharyngitis, Rhinitis, Smerter i thorax | |
| Vaskulære sygdomme | Perifere ødemer | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Trombocytopeni | |
| Hjerte | Angina pectoris | |
| Mave-tarm-kanalen | Opkastning | |
| Almene symptomer og reaktioner på administrationsstedet | Kraftesløshed, Utilpashed | |
| Immunsystemet | Anafylaktisk reaktion, Ansigtsødem | Urticaria |
| Knogler, led, muskler og bindevæv | Myalgi | |
| Hud og subkutane væv | Allergisk dermatitis, Hudkløe, Hududslæt | |
| Sjældne (0,01-0,1 %) | ||
| Almene symptomer og reaktioner på administrationsstedet | Letargi | |
| Immunsystemet | Angioødem, Intestinalt angioødem | |
| Metabolisme og ernæring | Hyperkaliæmi | |
| Knogler, led, muskler og bindevæv | Muskelkramper | |
| Nyrer og urinveje | Akut nyresvigt, Nyrefunktionspåvirkning | |
| Vaskulære sygdomme | Hypotension | |
| Ikke kendt hyppighed | ||
| Lever og galdeveje | Autoimmun hepatitis* | |
I meget sjældne tilfælde er der rapporteret om svær, kronisk diarré med omfattende vægttab. Ved disse symptomer skal behandlingen seponeres, og hvis diarreen ikke forbedres i løbet af en uges tid, bør yderligere undersøgelser overvejes.
* Autoimmun hepatitis med latenstid på få md. til år er reversibel efter seponering.
Kliniske aspekter
- Risiko for udtalt blodtryksfald er registreret hos patienter med stærkt aktiveret renin-angiotensin-aldosteron system, især i starten af behandling med kombinationsbehandling. Lavere startdosis kan anvendes.
- I tilfælde af angioneurotisk ødem (meget sjældent), er skift til anden AT2 receptor blokker eller ACE-hæmmer kontraindiceret.
- Svimmelhed, hovedpine samt ortostatisk hypotension er oftest forbigående.
Interaktioner
- Samtidig behandling med aliskiren hos patienter med diabetes eller nedsat nyrefunktion (GFR < 60 ml/min) kan give kraftige bivirkninger og er kontraindiceret.
- Kalium, kaliumbesparende diuretika og andre lægemidler, som øger serum-kalium kan forårsage hyperkaliæmi.
- Samtidig brug af ACE-hæmmere eller aliskiren øger risikoen for hypotension, hyperkaliæmi og nedsat nyrefunktion (inklusive akut nyresvigt). Kombinationen frarådes.
- Ved samtidig behandling med lithium kan serum-lithium øges, hvorfor kontrol af serum-lithium anbefales.
- NSAID kan svække den antihypertensive effekt.
Graviditet
Baggrund: Der er meget sparsomme data for angiotensin II-antagonister med lidt over 300 gravide eksponeret i 1. trimester af graviditeten. Der er beskrevet oligohydramnios, anuri, væksthæmning og neonatal hypotension, specielt ved eksponering i 2. og 3. trimester.
Der er ikke specifikke data for olmesartan, som tillader et meningsfyldt risikoestimat.
Se endvidere Hypertension hos gravide.
Amning
Bloddonor
Alkohol
Alkohol og Olmesartan medoxomil "Krka" påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
- Blokerer angiotensin-II-type 1-receptoren, hvilket resulterer i en forhøjelse af plasma-renin- og angiotensin-II-niveauerne samt nedsat aldosteron i plasma. Den kliniske effekt er universel vasodilatation uden sympatikusaktivering som ved ACE-hæmmere.
- Virkningen indtræder efter 2 uger og er maksimal efter ca. 8 uger.
Farmakokinetik
- Olmesartanmedoxomil er en prodrug, som under absorptionen fra mave-tarm-kanalen hydrolyseres til den aktive substans olmesartan.
- Biotilgængelighed ca. 26 %.
- Plasmahalveringstid 10-15 timer.
- 10-16 % udskilles gennem nyrerne, resten med galden.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 10 mg |
Farve
Andre
|
|
| 20 mg |
Farve
Andre
|
||
| 40 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (B) | filmovertrukne tabletter
10 mg
(kan dosisdisp.)
Olmesartan medoxomil "Krka" |
460017 |
98 stk. (blister)
|
488,00 | 4,98 | 9,96 | |
| (B) | filmovertrukne tabletter
20 mg
(kan dosisdisp.)
Olmesartan medoxomil "Krka" |
470656 |
98 stk. (blister)
|
591,60 | 6,04 | 6,04 | |
| (B) | filmovertrukne tabletter
40 mg
(kan dosisdisp.)
Olmesartan medoxomil "Krka" |
060992 |
98 stk. (blister)
|
669,30 | 6,83 | 3,41 |
Foto og identifikation
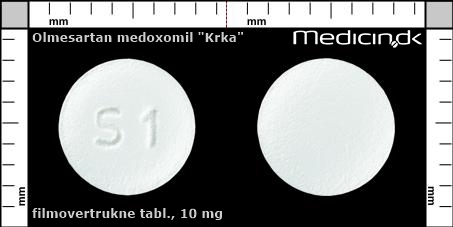
Filmovertrukne tabletter 10 mg |
| Præg: |
S1
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 6,6 x 6,6 |
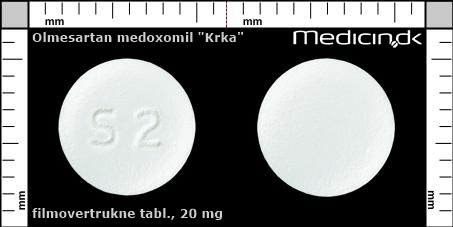
Filmovertrukne tabletter 20 mg |
| Præg: |
S2
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 8,2 x 8,2 |
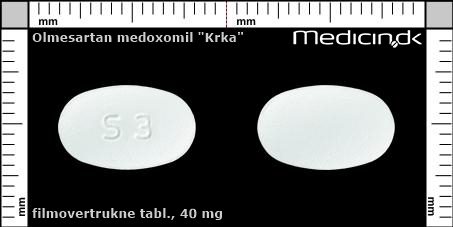
Filmovertrukne tabletter 40 mg |
| Præg: |
S3
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 8,2 x 13,3 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
4332. Shimada C, Akaishi R, Cho K et al. Outcomes of 83 fetuses exposed to angiotensin receptor blockers during the second or third trimesters: a literature review. Hypertens Res. 2015; 38(5):308-13, https://www.ncbi.nlm.nih.gov/pubmed/25693853 (Lokaliseret 3. marts 2022)
4329. Walfisch A, Al-maawali A, Moretti ME et al. Teratogenicity of angiotensin converting enzyme inhibitors or receptor blockers. J Obstet Gynaecol. 2011; 31(6):465-72, https://www.ncbi.nlm.nih.gov/pubmed/21823839 (Lokaliseret 3. marts 2022)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



