Yderligere information
Generel information
Anvendelsesområder
Behandling af kronisk hepatitis B hos voksne og børn ≥ 6 år med legemsvægt ≥ 25 kg.
Tenofoviralafenamid bør kun anvendes, når behandlingen forestås af læger med særligt kendskab til behandling af kronisk hepatitis B.
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 25 mg tenofoviralafenamid (som fumarat).
Doseringsforslag
Voksne og børn ≥ 6 år med legemsvægt ≥ 25 kg
- 25 mg 1 gang dgl. sammen med mad.
Seponering:
- HBeAg-positive uden cirrose
- Mindst 6-12 mdr. efter bekræftet HBe-serokonvertering
- For at detektere virologisk relaps efter seponering bør der evalueres regelmæssigt.
- HBeAg-negative uden cirrose
- Mindst indtil HBe-serokonvertering
- Ved behandling > 2 år bør der evalueres regelmæssigt for relevans af fortsat behandling.
Bemærk
- Tabletterne tages med et glas vand.
- Tabletterne kan knuses.
- Knust tablet kan opslæmmes i vand.
- Tages med mad.
- Bemærk: Knusning kan nedsætte/øge virkningen af tabletterne, og derfor er ekstra kontrol nødvendig.
- Glemt dosis kan tages sammen med mad indtil mindst 6 timer før næste dosis.
- Ved opkastning ≤ 1 time efter indtagelse tages en ny tablet sammen med mad.
- Erfaring savnes vedr. dekompenseret leversygdom med Child Pugh C.
- Erfaring savnes vedr. børn < 6 år eller med legemsvægt < 25 kg.
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 25 mg, Gilead Sciences Ingen kærv |
Mad og drikke
Tages med et glas vand.
Tages med mad.
Knusning/åbning
Kan knuses.
Bemærk: Knusning kan nedsætte/øge virkningen af tabletterne, og derfor er ekstra kontrol nødvendig.
Administration
Knust tablet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Forsigtighed, ingen eller begrænset erfaring
GFR: 0-30 ml/min.
Begrænset erfaring, da der ikke foreligger sikkerhedsdata.
GFR < 15 ml/min: Bør kun anvendes i forbindelse med hæmodialyse.
Der foreligger ingen data, der giver dosisanbefalinger for børn < 12 år og legemsvægt < 35 kg med nedsat nyrefunktion.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Forsigtighedsregler
- Erfaring savnes vedr. patienter med:
- dekompenseret leversygdom med Child Pugh C
- samtidig infektion med hepatitis C- eller D-virus.
- Da opblussen af hepatitis kan ses efter seponering, skal levertallene overvåges i flere måneder efter seponering.
- Da tenofoviralafenamid virker på HIV, skal der foreligge en negativ HIV-test inden behandlingsstart, da monobehandling af HIV vil medføre resistensudvikling.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Nervesystemet | Hovedpine | |
| Almindelige (1-10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Flatulens, Kvalme, Meteorisme, Opkastning |
| Almene symptomer og reaktioner på administrationsstedet | Træthed | |
| Undersøgelser | Forhøjet ALAT | |
| Knogler, led, muskler og bindevæv | Artralgi | |
| Nervesystemet | Svimmelhed | |
| Hud og subkutane væv | Hudkløe, Hududslæt | |
| Ikke almindelige (0,1-1 %) | ||
| Immunsystemet | Angioødem | Urticaria |
Interaktioner
- Bør ikke anvendes samtidig med andre lægemidler, der indeholder tenofoviralafenamid, tenofovirdisoproxil eller adefovirdipivoxil.
- Ved samtidig brug af P-gp-induktorer, fx carbamazepin, naturlægemidler med perikon, phenobarbital, rifabutin eller rifampicin, forventes nedsat plasmakoncentration af tenofoviralafenamid. Kombination frarådes.
- Ved samtidig brug af visse proteasehæmmere sammen med/uden farmakokinetisk booster, fx atazanavir/cobicistat, kan plasmakoncentrationen af tenofoviralafenamid øges. Kombination frarådes.
- Itraconazol eller ketoconazol forventes at øge plasmakoncentrationen af tenofoviralafenamid. Kombination frarådes.
Graviditet
Baggrund: Der er data for omkring 900 1. trimester-eksponerede (oftest i kombinationsbehandling) uden tegn på overhyppighed af uønsket fosterpåvirkning. I et randomiseret studie blandt 643 kvinder efter 2. trimester indgik tenofovir i alle tre arme (tenofovir afenalamid i én arm, tenofovir disoproxil i to arme) i kombination med to andre antiretrovirale lægemidler. Der var mindre forskelle de tre arme imellem i forhold til preterm fødsel og neonatal død, men man kan ikke isolere den specifikke betydning af tenofovir.
Se også Klassifikation - graviditet
Amning
Baggrund: Der er ikke kvantitative data for udskillelse i modermælk.
Bloddonor
Alkohol
Alkohol og Vemlidy påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
- Nukleosid- og nukleotidanalog RT-hæmmer mod hepatitis B-virus.
- Omdannes intracellulært til den aktive metabolit.
Farmakokinetik
- Tenofoviralafenamid er en prodrug, som i primære hepatocytter og lymfocytter omdannes til den aktive substans tenofovir.
- Biotilgængeligheden af tenofoviralafenamid stiger med ca. 65 % ved samtidig indtagelse af fedtrigt måltid.
- Maksimal plasmakoncentration efter ca. 0,5 time (tenofoviralafenamid).
- Plasmahalveringstid ca. 32 timer (tenofovir).
- Tenofovir udskilles gennem nyrerne.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 25 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | filmovertrukne tabletter
25 mg
Vemlidy |
069912 |
30 stk.
|
4.485,50 | 149,52 | 149,52 | |
| (BEGR) | filmovertrukne tabletter
25 mg
Vemlidy |
551289 |
30 stk. (Abacus)
|
4.683,80 | 156,13 | 156,13 |
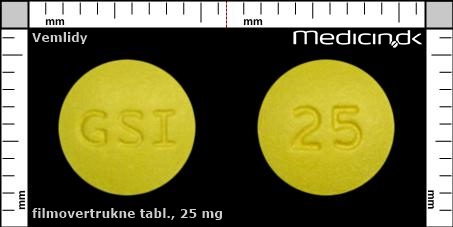
Foto og identifikation
Filmovertrukne tabletter 25 mg |
| Præg: |
GSI, 25
|
| Kærv: | Ingen kærv |
| Farve: | Gul |
| Mål i mm: | 8 x 8 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
5582. Lockman S, Brummel SS, Ziemba L et al. Efficacy and safety of dolutegravir with emtricitabine and tenofovir alafenamide fumarate or tenofovir disoproxil fumarate, and efavirenz, emtricitabine, and tenofovir disoproxil fumarate HIV antiretroviral therapy regimens started in pregnancy (IMPAACT 2010/VESTED): a multicentre, open-label, randomised, controlled, phase 3 trial. Lancet. 2021; 397(10281):1276-92, https://pubmed.ncbi.nlm.nih.gov/33812487/ (Lokaliseret 23. oktober 2023)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



