Yderligere information
Generel information
Relevante links
Middel med antiinflammatorisk virkning ved reumatoid artritis og psoriasis artritis.
Anvendelsesområder
- Aktiv reumatoid artritis, hvor anden behandling har haft utilstrækkelig effekt eller medført uacceptable bivirkninger
- Aktiv psoriasisartritis.
Leflunomid bør kun anvendes, når behandlingen forestås af speciallæge i reumatologi.
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 10 mg leflunomid.
Doseringsforslag
Aktiv reumatoid artritis
- Voksne. Initialt 100 mg 1 gang dgl. i 3 dage. Vedligeholdelsesdosis. 10-20 mg 1 gang dgl. Evt. startes med vedligeholdelsesdosis.
Aktiv psoriasis artritis
- Voksne. Initialt 100 mg 1 gang dgl. i 3 dage. Vedligeholdelsesdosis. 20 mg 1 gang dgl. Evt. startes med vedligeholdelsesdosis.
Bemærk:
- Behandlingen skal foregå under regelmæssig klinisk observation (hud- og slimhindereaktioner, infektioner) og kontrol af biokemi hver 14. dag i 6 måneder, derefter hver 8.-12. uge. Kontrollen omfatter: hæmoglobin, trombocyt- og leukocyttal (inkl. differentialtælling), transaminaser (serum-ALAT/ASAT) og blodtryk.
- Erfaring savnes vedr. patienter under 18 år.
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 10 mg, Sanofi Ingen kærv |
Mad og drikke
Tages med et glas vand.
Kan tages med eller uden mad.
Knusning/åbning
Må ikke knuses.
Administration
Synkes hele.
Tablet kan opslæmmes i vand.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Kontraindiceret, erfaring savnes
GFR: 0-60 ml/min.
Dosisjustering er ikke nødvendig ved let nedsat nyrefunktion. Kontraindiceret ved GFR < 60 ml/min. Der findes ingen data.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
Kontraindikationer
- Svær immundefekt, fx AIDS, alvorligt nedsat knoglemarvsfunktion med anæmi, leukopeni, neutropeni eller trombocytopeni, som skyldes andre årsager end reumatoid artritis
- Alvorlige infektioner.
- Svær hypoproteinæmi, fx nefrotisk syndrom.
Forsigtighedsregler
- Inden behandlingsstart skal der screenes for aktiv og latent tuberkulose.
- Ved alvorlige bivirkninger eller ved umiddelbart skift til et andet sygdomsmodificerende antireumatikum bør udvaskningsproceduren iværksættes, se forgiftning.
- Serum-ALAT/ASAT samt blodtryk bør kontrolleres, før behandlingen påbegyndes og derefter hver 14. dag i 6 måneder. Hvis leverenzymerne stiger til mere end 2-3 gange øvre normalgrænse, bør behandlingen seponeres.
- Alkoholindtagelse bør undgås under behandlingen.
- Leflunomidbehandling bør tidligst iværksættes ca. 4 uger efter forudgående behandling med et andet langsomt virkende antireumatikum, se doseringsforslag.
- Vaccination med levende vacciner bør undgås under behandlingen, da erfaring savnes.
- Samtidig behandling med methotrexat er forbundet med øget risiko for alvorlige leverbivirkninger og anbefales generelt ikke.
- Ved mistanke om leflunomid-relateret hudsår, eller hvis hudsårene vedvarer på trods af passende behandling, bør det overvejes at seponere leflunomid og foretage en fuldstændig udvaskningsprocedure.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Leukopeni | |
| Mave-tarm-kanalen | Abdominalsmerter, Colitis, Stomatitis | Diarré, Kvalme, Opkastning, Orale ulcera |
| Almene symptomer og reaktioner på administrationsstedet | Kraftesløshed | |
| Immunsystemet | Allergiske reaktioner | |
| Traumer, forgiftninger og behandlingskomplikationer | Tendinitis | |
| Undersøgelser | Forhøjede leverenzymer, Forhøjet plasma-kreatinkinase, Vægttab | |
| Metabolisme og ernæring | Nedsat appetit | |
| Nervesystemet | Paræstesier, Perifer neuropati, Svimmelhed | Hovedpine |
| Hud og subkutane væv | Alopeci, Eksem | Hudkløe, Hududslæt, Tør hud |
| Vaskulære sygdomme | Hypertension | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Anæmi, Trombocytopeni | |
| Mave-tarm-kanalen | Smagsforstyrrelser | |
| Immunsystemet | Urticaria | |
| Traumer, forgiftninger og behandlingskomplikationer | Seneruptur | |
| Metabolisme og ernæring | Hyperlipidæmi, Hypofosfatæmi, Hypokaliæmi | |
| Psykiske forstyrrelser | Angst | |
| Sjældne (0,01-0,1 %) | ||
| Blod og lymfesystem | Eosinofili, Pancytopeni | |
| Lever og galdeveje | Hepatitis, Kolestase, Levercellenekrose, Leverinsufficiens | Icterus |
| Infektioner og parasitære sygdomme | Alvorlige infektioner | |
| Luftveje, thorax og mediastinum | Interstitiel pneumonitis | |
| Meget sjældne (< 0,01 %) | ||
| Mave-tarm-kanalen | Pancreatitis | |
| Lever og galdeveje | Hepatotoksicitet | |
| Immunsystemet | Anafylaktisk reaktion, Stevens-Johnsons syndrom | |
| Hud og subkutane væv | Erythema multiforme, Toksisk epidermal nekrolyse (TEN) | |
| Ikke kendt hyppighed | ||
| Immunsystemet | Forværring af psoriasis | |
| Knogler, led, muskler og bindevæv | Kutan lupus erythematosus-lignende reaktion | |
| Nyrer og urinveje | Nyresvigt | |
| Hud og subkutane væv | Lægemiddelreaktion med eosinofili og systemiske symptomer - DRESS, Sårdannelse | |
| Vaskulære sygdomme | Pulmonal hypertension | |
Kliniske aspekter
De hyppigst rapporterede bivirkninger er let blodtryksstigning, leukopeni, paræstesi, hovedpine, svimmelhed, diarré, kvalme, opkastning, gener fra mundslimhinden, (fx aftøs stomatitis, mundsår), abdominalsmerter, øget hårtab, eksem, hududslæt pruritus, tør hud, seneskedehindebetændelse, øget kreatinkinase, anoreksi, vægttab (sædvanligvis ubetydeligt), asteni, milde allergiske reaktioner og stigning i leverparametre (aminotransferaser særligt ALAT).
Leflunomid kan hæmme sårheling.
Interaktioner
Øget risiko for bivirkninger i tilfælde af nylig eller samtidig anvendelse af hepatotoksiske eller hæmatotoksiske lægemidler, eller såfremt leflunomidbehandlingen efterfølges af behandling med sådanne lægemidler uden forudgående udvaskningsperiode.
Der er teoretisk risiko for interaktioner med lægemidler, der omsættes af CYP2C9, fx warfarin, se tabel 2 i Elimination og cytokrom P450-systemet.
Colestyramin og aktivt kul nedsætter koncentrationen af den aktive metabolit.
Graviditet
Baggrund: En metabolit af leflunomid er mistænkt for fosterskadelige effekter. Humane data er beskedne med data for ca. 200 1. trimester-eksponerede. Disse data tyder ikke på en væsentligt øget risiko for medfødte misdannelser, men kan ikke udelukke en noget øget risiko. Se endvidere Methotrexat og immunosuppressiva mod psoriasis.
Se også Klassifikation - graviditet
Fertile kvinder og mænd
For kvinder med graviditetsønske skal leflunomid seponeres, og pga. den aktive metabolits lange halveringstid anbefales en karantæneperiode på 2 år inden forsøg på graviditet. Alternativt kan der gennemføres en udvaskningsprocedure med colestyramin (som beskrevet i produktresuméet), som afbryder den enterohepatiske recirkulation af metabolitten.
Amning
Bloddonor
Doping

|
Ingen restriktioner |
Alkohol
Forsigtighed ved indtag af alkohol under behandling med Arava®.
Der er potentiel risiko for additive hepatotoksiske virkninger.
Forgiftning
Ved symptomgivende forgiftning tilrådes iværksat følgende udvaskningsprocedure: 8 g colestyramin oralt 3 gange dgl. i 11 dage eller 50 g aktivt kul 4 gange dgl. i 11 dage.
(Evidensen af udvaskning med cholestyramin er kun vist i en kasuistisk meddelelse ang. toksisk pneumonitis).
Farmakodynamik
Det antages, at praktisk taget alle leflunomids in vivo-effekter kan henføres til den aktive metabolit A771726, der hæmmer enzymet dihydroorotatdehydrogenase. Herved reduceres de novo syntese af pyrimidin og dermed DNA-baserne cytosin og thymin. Aktiverede lymfocytter er afhængige af denne syntese, mens andre celler via andre synteseveje kan danne disse stoffer. Dette forklarer leflunomids antiinflammatoriske effekt. Virkningen indtræder efter ca. 5 uger.
Farmakokinetik
- Leflunomid undergår fuldstændig first pass-metabolisme i tarmvæg og lever til den aktive metabolit A771726.
- Maksimal plasmakoncentration efter 1-24 timer (A771726).
- Steady state efter ca. 3 dage (ved dosering med initial støddosis i 3 dage) og ca. 2 måneder (uden dosering med støddosis).
- Plasmahalveringstid 1-4 uger (A771726), og metabolitten kan påvises i kroppen i indtil 2 år efter behandlingsophør. Enterohepatisk cirkulation forekommer.
- Udskilles gennem nyrerne (primært som inaktive metabolitter) og med galden (primært som A771726).
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 10 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (NBS) (Med.Rheum.) | filmovertrukne tabletter
10 mg
Arava |
053371 |
100 stk.
|
1.715,85 | 17,16 | 34,32 |
Substitution
| filmovertrukne tabletter 10 mg |
|---|
| Leflunomide medac Medac, Leflunomid, filmovertrukne tabletter 10 mg |
| Leflunomide Zentiva Zentiva, Leflunomid, filmovertrukne tabletter 10 mg |
Foto og identifikation
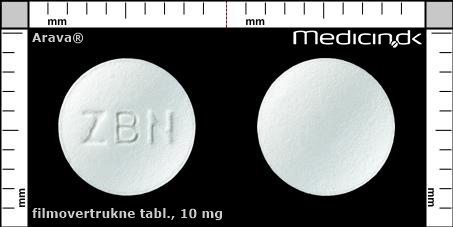
Filmovertrukne tabletter 10 mg |
| Præg: |
ZBN
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 7,1 x 7,1 |
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
4508. Bérard A, Zhao JP, Shui I et al. Leflunomide use during pregnancy and the risk of adverse pregnancy outcomes. Ann Rheum Dis. 2018; 77(4):500-9, https://www.ncbi.nlm.nih.gov/pubmed/29222350 (Lokaliseret 3. marts 2022)
4510. Weber-Schoendorfer C, Beck E, Tissen-Diabaté T et al. Leflunomide - A human teratogen? A still not answered question. An evaluation of the German Embryotox pharmacovigilance database. Reprod Toxicol. 2017; 71:101-7, https://www.ncbi.nlm.nih.gov/pubmed/28478049 (Lokaliseret 3. marts 2022)
4509. Cassina M, Johnson DL, Robinson LK et al. Pregnancy outcome in women exposed to leflunomide before or during pregnancy. Arthritis Rheum. 2012; 64(7):2085-94, https://www.ncbi.nlm.nih.gov/pubmed/22307734 (Lokaliseret 3. marts 2022)
4511. Chambers CD, Johnson DL, Robinson LK et al. Birth outcomes in women who have taken leflunomide during pregnancy. Information Specialists Collaborative Research Group. 2010; 62(5):1494-503, https://www.ncbi.nlm.nih.gov/pubmed/20131283 (Lokaliseret 3. marts 2022)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



