Generel information
Antineoplastisk middel. Proteinkinasehæmmer.
Anvendelsesområder
- BRAFV600-mutationspositivt ikke-operabelt eller metastatisk melanom som monoterapi eller i kombination med dabrafenib.
- BRAFV600-mutationspositivt stadie III melanom i kombination med dabrafenib efter komplet resektion.
- BRAFV600-mutationspositivt ikke-småcellet lungecancer i kombination med dabrafenib.
Trametinib bør kun anvendes, når behandlingen forestås af læger med særligt kendskab til maligne lidelser og deres behandling.
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 0,5 mg eller 2 mg trametinib (som dimethylsulfoxid).
Doseringsforslag
Voksne. 2 mg 1 gang dgl.
Bivirkninger kan nødvendiggøre dosisreduktion, pausering eller seponering af behandlingen, se produktresumé.
Bemærk:
- Hvis patienten kaster op efter at have taget trametinib, bør der ikke tages en ny dosis, men vente til den næste planlagte dosis.
- Erfaring savnes vedr. patienter < 18 år.
Glemt medicin
En glemt dosis tages kun, hvis der er over 12 timer til næste planlagte dosis.
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 0,5 mg, Novartis Ingen kærv |
| filmovertrukne tabletter 2 mg, Novartis Ingen kærv |
Mad og drikke
Tages med et glas vand.
Tages på tom mave mindst 1 time før eller mindst 2 timer efter et måltid.
Knusning/åbning
Må ikke knuses.
Administration
Synkes hele.
Må ikke tygges.
OBS
Dosis bør tages på omtrent samme tidspunkt hver dag.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Forsigtighed, erfaring savnes
GFR: 0-30 ml/min.
Dosisjustering er ikke nødvendig ved let til moderat nedsat nyrefunktion. Erfaring savnes ved GFR < 30 ml/min. Der findes ingen data, og forsigtighed tilrådes.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
Forsigtighedsregler
Monitorering
- Blodtryksændringer: Både hyper- og hypotension forekommer. Blodtrykket bør måles før behandlingen og følges under behandlingen.
- Hudundersøgelser: Anbefales før behandlingen og månedligt under behandlingen, se nedenfor.
- Leverpåvirkning: Pga. risiko for leverpåvirkning anbefales monitorering af leverfunktionen hver 4. uge i de første 6 måneder og efter klinisk vurdering.
- Nyrefunktion: Der kan være risiko for nyresvigt og nefritis. Regelmæssig måling af nyrefunktion under behandlingen anbefales.
- Nedsat funktion af venstre ventrikel: Uddrivningsfraktion skal måles hos alle patienter før opstart af behandling med trametinib og følges under behandlingen.
Retinal veneokklusion (RVO)
Forskellige tilstande med synsforstyrrelser, herunder RVO, er forekommet under behandlingen. Behandling med trametinib anbefales ikke ved tidligere RVO. Erfaring savnes ved tilstande, der kan disponere for RVO som fx okulær hypertension samt ukontrolleret glaukom, hypertension eller diabetes.
Risiko for kutan malignitet og alvorlige hudreaktioner
Der er forekommet tilfælde af kutane maligniteter samt alvorlige hudreaktioner som Steven-Johnsosns syndrom under behandling med trametinib i kombination med dabrafenib. Hudundersøgelse anbefales før behandlingsstart, hver måned under behandlingen samt op til 6 måneder efter seponering. Patienten skal instrueres i at kontakte lægen ved tegn på alvorlig hudreaktion.
Risikofaktorer for GI-perforation
Tilfælde af colitis, enterocolitis og gastrointestinal perforation er forekommet. Forsigtighed ved risikofaktorer for gastrointestinal perforation som fx divertikulitis, metastaser i mave-tarm-kanalen og anvendelse af visse lægemidler (fx NSAID, lenalidomid).
Ved kombinationsbehandling med dabrafenib er registreret:
- Tilfælde af hæmofagocytisk lymfohistiocytose (HLH). Hvis HLH bekræftes, seponeres behandling og relevant behandling for HLH opstartes.
- Der er rapporteret tilfælde af tumorlysesyndrom (TLS). Derfor skal patienter med sygdomme med høj risiko for tumorlyse monitoreres for tumorlyse og have passende forebyggende behandling i henhold til anvendte retningslinjer.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Blod og lymfesystem | Blødning | |
| Mave-tarm-kanalen | Abdominalsmerter | Diarré, Kvalme, Mundtørhed, Obstipation, Opkastning |
| Almene symptomer og reaktioner på administrationsstedet | Temperaturstigning, Træthed | |
| Undersøgelser | Forhøjet ASAT | |
| Luftveje, thorax og mediastinum | Dyspnø | Hoste |
| Hud og subkutane væv | Alopeci | Acnelignende hududslæt, Hudkløe, Hududslæt, Tør hud |
| Vaskulære sygdomme | Hypertension, Perifere ødemer | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Anæmi | |
| Hjerte | Bradykardi, Venstresidig hjerteinsufficiens | |
| Øjne | Sløret syn, Synstab | |
| Mave-tarm-kanalen | Stomatitis | |
| Almene symptomer og reaktioner på administrationsstedet | Mucositis | Kraftesløshed |
| Immunsystemet | Allergiske reaktioner, Ansigtsødem, Periorbitalt ødem | |
| Infektioner og parasitære sygdomme | Pustuløst hududslæt | Negleinfektion |
| Undersøgelser | Nedsat uddrivningsfraktion | Forhøjet ALAT, Forhøjet basisk fosfatase, Forhøjet plasma-kreatinkinase |
| Metabolisme og ernæring | Dehydrering | |
| Nervesystemet | Perifer neuropati ( herunder sensorisk og motorisk neuropati) | |
| Luftveje, thorax og mediastinum | Pneumonitis* | |
| Hud og subkutane væv | Cellulitis, Erytem, Folliculitis, Fotosensibilitet, Palmar-plantar erytrodysæstesi | Hudfissurer |
| Vaskulære sygdomme | Lymfødem | |
| Ikke almindelige (0,1-1 %) | ||
| Hjerte | AV-blok (herunder AV-blok grad 1), Hjerteinsufficiens | |
| Øjne | Nethindeløsning, Papilødem, Retinal blodprop, Retinopati | |
| Mave-tarm-kanalen | Colitis, Gastro-intestinal perforation | |
| Immunsystemet | Sarkoidose | |
| Knogler, led, muskler og bindevæv | Rhabdomyolyse | |
| Luftveje, thorax og mediastinum | Interstitiel lungesygdom* | |
| Hud og subkutane væv | Akut febril neutrofil dermatose | |
| Sjældne (0,01-0,1 %) | ||
| Blod og lymfesystem | Hæmofagocytisk lymfohistiocytose** | |
| Ikke kendt hyppighed | ||
| Hjerte | Kardielle ledningsforstyrrelser (atrioventrikulært blok) | |
| Immunsystemet | Stevens-Johnsons syndrom | |
| Benigne, maligne og uspecificerede neoplasmer | Tumorlysesyndrom | |
| Hud og subkutane væv | Eksfoliativ dermatitis, Lægemiddelreaktion med eosinofili og systemiske symptomer - DRESS | |
* Trametinib seponeres ved pneumonitis eller interstitiel lungesygdom. Behandling med dabrafenib kan evt. fortsætte.
** Behandlingen seponeres ved udvikling af hæmofagocytisk lymfohistiocytose.
Håndtering af temperaturstigning
- Behandlingen med trametinib/dabrafenib bør afbrydes ved temperaturstigning ≥ 38 ºC.
- Ved tilbagevendende temperaturstigning kan afbrydelse af behandlingen overvejes ved først tegn på øget temperatur.
- Behandling med antipyretika (fx paracetamol eller ibuprofen) bør opstartes. Ved manglende effekt kan overvejes behandling med kortikosteroider.
- Ved normalisering af temperaturen kan behandlingen genoptages. Har temperaturstigningen været ledsaget af andre symptomer (fx dehydrering, hypotension, nyresvigt, svære kulderystelser) kan behandlingen evt. genoptages med reduceret dosis.
Interaktioner
- Trametinib kan forbigående hæmme transportørproteinet BCRP i tarmen og kan derfor øge virkningen af substrater af BCRP (fx methotrexat, rosuvastatin og sulfasalazin). 2 timers dosisforskydning anbefales.
- Trametinib er et in vitro substrat for P-glykoprotein (p-gp). Forsigtighed ved samtidig brug af potente hæmmere af hepatisk p-gp, fx verapamil, ciclosporin, ritonavir, itraconazol.
Graviditet
Baggrund: Enhver antineoplastisk behandling under graviditet vil være resultatet af en meget individuel og specifik vurdering af den underliggende sygdom, prognose, behandlingsalternativer og patientinvolvering. Der er ingen antineoplastiske lægemidler hvor der er kvantitative eller kvalitative humane data, som tillader et meningsfyldt risikoestimat. Generelt, på tværs af alle antineoplastiske lægemidler og de behandlede sygdomme, synes risikoen for medfødte misdannelser dog ikke væsentligt forøget. Såfremt der er behov for en detaljeret gennemgang af evidensen for det enkelte specifikke lægemiddel, anbefales kontakt til en Klinisk Farmakologisk Lægemiddelrådgivning.
Se også Antineoplastiske midler.
Se også Klassifikation - graviditet
Fertile kvinder og mænd
Kvinder i den fertile alder skal anvende sikker kontraception under behandlingen og i 4 måneder efter behandlingsophør. Det vides ikke, om trametinib kan nedsætte effekten af hormonale kontraceptiva, og der bør derfor anvendes anden kontraceptionsmetode under behandlingen og i 4 måneder efter behandlingsophør.
Amning
Baggrund: På grund af virkningsmekanismen frarådes amning.
Bloddonor
Alkohol
Alkohol og Mekinist påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Hæmmer den aktiverede serin-threorinkinase BRAFV600, som er resultat af en mutation i BRAF-genet, via inhibition af dens substratproteiner MEK 1 og 2.
Farmakokinetik
- Maksimal plasmakoncentration efter ca. 1,5 timer.
- Fordelingsvolumen ca. 17 l/kg.
- Plasmahalveringstid ca. 5 døgn.
Egenskaber, håndtering og holdbarhed
Holdbarhed
- Opbevares i den originale beholder for at beskytte mod lys og fugt.
- Efter åbning: Kan opbevares ved < 30 ºC i højst 30 dage.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 0,5 mg |
Farve
Andre
|
|
| 2 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | filmovertrukne tabletter
0,5 mg
Mekinist |
374194 |
30 stk.
|
16.045,20 | 534,84 | 2.139,36 | |
| (BEGR) | filmovertrukne tabletter
2 mg
Mekinist |
178273 |
30 stk.
|
56.966,50 | 1.898,88 | 1.898,88 |
Foto og identifikation
Filmovertrukne tabletter 0,5 mg (Nyt udseende) |
| Præg: |
TT,
 |
| Kærv: | Ingen kærv |
| Farve: | Gul |
| Mål i mm: | 5 x 9 |

Filmovertrukne tabletter 0,5 mg (Udfases) |
| Præg: |
TFC, GS
|
| Kærv: | Ingen kærv |
| Farve: | Gul |
| Mål i mm: | 5 x 9 |

Filmovertrukne tabletter 2 mg (Nyt udseende) |
| Præg: |
LL,
 |
| Kærv: | Ingen kærv |
| Farve: | Lyserød |
| Mål i mm: | 7,6 x 7,6 |
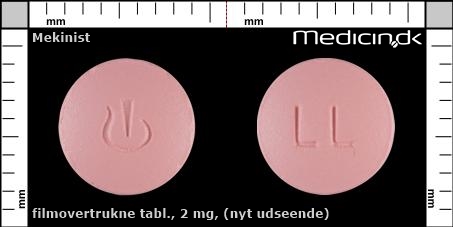
Filmovertrukne tabletter 2 mg (Udfases) |
| Præg: |
HMJ, GS
|
| Kærv: | Ingen kærv |
| Farve: | Lyserød |
| Mål i mm: | 7,5 x 7,5 |
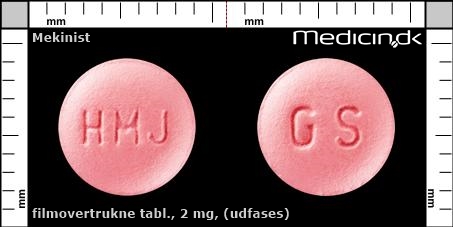
Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
4264. Danet C, Araujo M, Bos-Thompson MA et al. Pregnancy outcomes in women exposed to cancer chemotherapy. Pharmacoepidemiol Drug Saf. 2018; 27(12):1302-8, https://www.ncbi.nlm.nih.gov/pubmed/30379378 (Lokaliseret 24. februar 2022)
4388. de Haan J, Verheecke M, Van Calsteren K et al. Oncological management and obstetric and neonatal outcomes for women diagnosed with cancer during pregnancy: a 20-year international cohort study of 1170 patients. Lancet Oncol. 2018; 19(3):337-46, https://www.ncbi.nlm.nih.gov/pubmed/29395867 (Lokaliseret 3. marts 2022)
2954. Miyamoto S, Yamada M, Kasai Y et al. Anticancer drugs during pregnancy. Jpn J Clin Oncol. 2016; 46(9):795-804, https://www.ncbi.nlm.nih.gov/pubmed/27284093 (Lokaliseret 10. maj 2023)
2955. Esposito S, Tenconi R, Preti V et al. Chemotherapy against cancer during pregnancy: A systematic review on neonatal outcomes. Medicine (Baltimore). 2016; 95(38), https://www.ncbi.nlm.nih.gov/pubmed/27661036 (Lokaliseret 10. maj 2023)
4268. Loibl S, Schmidt A, Gentilini O et al. Breast Cancer Diagnosed During Pregnancy: Adapting Recent Advances in Breast Cancer Care for Pregnant Patients. JAMA Oncol. 2015; 8:1145-53, https://www.ncbi.nlm.nih.gov/pubmed/26247818 (Lokaliseret 24. februar 2022)
4270. Peccatori FA, Azim HA Jr, Orecchia R et al. Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013, https://www.ncbi.nlm.nih.gov/pubmed/23813932 (Lokaliseret 24. februar 2022)
4269. Loibl S, Han SN, von Minckwitz G et al. Treatment of breast cancer during pregnancy: an observational study. Lancet Oncol. 2012; 13(9):887-96, https://www.ncbi.nlm.nih.gov/pubmed/22902483 (Lokaliseret 24. februar 2022)
2789. Azim HA Jr, Peccatori FA, Pavlidis N. Treatment of the pregnant mother with cancer: a systematic review on the use of cytotoxic, endocrine, targeted agents and immunotherapy during pregnancy. Part I: Solid tumors. Cancer Treat Rev. 2010; 36(2):101-9, http://www.ncbi.nlm.nih.gov/pubmed/20015593 (Lokaliseret 4. maj 2023)
2790. Azim HA Jr, Pavlidis N, Peccatori FA. Treatment of the pregnant mother with cancer: a systematic review on the use of cytotoxic, endocrine, targeted agents and immunotherapy during pregnancy. Part II: Hematological tumors. Cancer Treat Rev. 2010; 36(2):110-21, http://www.ncbi.nlm.nih.gov/pubmed/20018452 (Lokaliseret 4. maj 2023)
691. Cardonick E, Iacobucci A. Use of chemotherapy during human pregnancy. Lancet Oncol. 2004; 5(5):283-91, https://pubmed.ncbi.nlm.nih.gov/15120665/ (Lokaliseret 7. december 2021)
4267. PDQ Adult Treatment Editorial Board. Breast Cancer Treatment During Pregnancy (PDQ®): Health Professional Version. PDQ Cancer Information Summaries, National Cancer Institute (US). 2002-2017, https://www.ncbi.nlm.nih.gov/pubmed/26389427 (Lokaliseret 24. februar 2022)
692. Arnon J, Meirow D, Lewis-Roness H et al. Genetic and teratogenic effects of cancer treatments on gametes and embryos. Hum Reprod Update. 2001; 7(4):394-403, https://pubmed.ncbi.nlm.nih.gov/11476352/ (Lokaliseret 7. december 2021)
1550. SPC, Lægemiddelstyrelsen. , http://www.produktresume.dk (Lokaliseret 17. marts 2023)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)
3966. SPC, EMA. European Medicines Agency. , https://www.ema.europa.eu/en/medicines (Lokaliseret 6. februar 2024)



