Generel information
Middel mod idiopatisk pulmonal fibrose (IPF) og progressiv pulmonal fibrose (PPF).
Anvendelsesområder
- Idiopatisk pulmonal fibrose (IPF).
- Systemisk sklerodermi-associeret interstitiel lungesygdom (SSc-ILS).
- Andre fibroserende interstitielle lungesygdomme med progressiv fænotype.
Præparatet bør kun anvendes, når behandlingen forestås af læger med særligt kendskab til behandling af pågældende lungesygdomme.
Medicinrådet har lavet en vurdering af præparatet.
Dispenseringsform
Kapsler, bløde. 1 kapsel indeholder 25 mg, 100 mg eller 150 mg nintedanib.
Doseringsforslag
Voksne
- 150 mg 2 gange dgl. med ca. 12 timers interval.
- Ved bivirkninger kan dosis nedsættes til 100 mg 2 gange dgl. eller behandlingen kan pauseres.
Børn og unge 6-17 år
Begrænset erfaring. Et studie har vist eksponering tilsvarende voksne og acceptabel sikkerhedsprofil ved dosering efter vægt baseret på allometrisk skalering (6226).
Bemærk:
- Erfaring savnes vedr. børn under 6 år.
Håndtering af kapsler og tabletter
| bløde kapsler 25 mg, Boehringer Ingelheim |
| bløde kapsler 100 mg, Boehringer Ingelheim |
| bløde kapsler 150 mg, Boehringer Ingelheim |
Mad og drikke
Tages med et glas vand.
Tages med mad.
Knusning/åbning
Må ikke åbnes.
Administration
Synkes hele.
Må ikke tygges.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Forsigtighed, erfaring savnes
GFR: 0-30 ml/min.
Sikkerhed, virkning og farmakokinetik er ikke undersøgt. Tilfælde af nyresvigt med dødelig udgang er forekommet.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
- Mulig øget risiko for bivirkninger ved let nedsat leverfunktion (Child-Pugh A). Dosis nedsættes til 100 mg 2 gange dgl. med ca. 12 timers mellemrum.
- Ingen erfaring ved moderat (Child-Pugh B) eller stærkt ( Child-Pugh C) nedsat leverfunktion.
Forsigtighedsregler
Blødningsrisiko
VEGFR-hæmning kan være forbundet med blødningsrisiko. I studier er der set lidt højere forekomst af ikke-alvorlige blødning (fx epistaxis), mens forekomsten af alvorlige blødninger var på niveau med placebo. Efter markedsføring er der rapporteret enkelttilfælde af alvorlig blødning hos patienter i behandling med nintedanib. Forsigtighed ved øget risiko for blødning.
Risiko for aneurismer/arterielle dissektioner
Det er set, at VEGF-hæmmere kan fremme dannelse af aneurismer og/eller arterielle dissektioner. Risikoen bør overvejes for patienter med risikofaktorer - fx hypertension eller tidligere aneurismer (blodtrykket skal være velreguleret før behandlingen startes).
Trombotisk mikroangiopati
Der er set tilfælde af trombotisk mikroangiopati (TMF) hos patienter i behandling med VEGF-hæmmere - herunder meget få tilfælde hos patienter i behandling med nintedanib. Ved symptomer eller laboratoriefund, der kan associeres til TMF, bør behandlingen seponeres og evaluering for TMF foretages.
Risiko for gastro-intestinal perforation og iskæmisk colitis
Gastro-intestinal perforation og iskæmsik colitis er set i meget få tilfælde:
- Forsigtighed ved tidligere abdominalkirurgi og ulcus pepticum eller diverticulosis coli i anamnesen eller samtidig behandling med NSAID eller glukokortikoider.
- Pga. mulig risiko for hæmmet opheling og perforation anbefales det i produktresumeet, at behandlingen tidligst startes 4 uger efter evt. abdominalkirurgi, men dette må opvejes mod risikoen for akut forværring af IPF ved pausering.
- Ved gastro-intestinal perforation eller iskæmisk colitis bør behandlingen seponeres. Det kan overvejes at genoptage behandlingen efter en evt. iskæmisk colitis er væk.
Sårheling
Opmærksomhed på, at nintedanib potentielt kan hæmme sårheling iht. virkningsmekanismen, men kliniske data foreligger ikke.
Elektiv kirurgi
Ved kirurgi bør behandlingen med nintedanib pauseres, fx 1 uge før til 1 uge efter operationen.
Blodtryk
Blodtrykket skal være velkontrolleret før behandling med nintedanib og der bør, pga. risiko for hypertension, måles blodtryk regelmæssigt under behandlingen eller ved klinisk indikation.
Monitorering af leverfunktion
Ingen erfaring ved moderat (Child-Pugh B) eller stærkt ( Child-Pugh C) nedsat leverfunktion. Mulig øget risiko for bivirkninger ved let nedsat leverfunktion ( Child-PughA).
ALAT bør måles:
- Før behandling påbegyndes
- Løbende under behandlingen, med højeste frekvens i starten af behandlingen, fx efter 2 uger, månedligt de næste 6 måneder og derefter hver 3. måned samt efter klinisk indikation.
- Særlig opmærksomhed anbefales ved øget risiko for forhøjede leverenzymer (fx vægt under 65 kg., kvinder, patienter af asiatisk herkomst):
- Ved ALAT over 3 gange øvre normalgrænse nedsættes dosis, eller behandlingen seponeres, indtil ALAT er inden for normalområdet. Behandlingen kan herefter genoptages med enten fuld dosis (150 mg 2 gange dgl.) eller reduceret dosis (100 mg 2 gange dgl.), der så kan øges til fuld dosis.
- Ved ALAT over 3 gange øvre normalgrænse med samtidige symptomer på nedsat leverfunktion seponeres behandlingen permanent.
Kontraception
Det skal sikres, at fertile kvinder ikke er gravide, før behandlingen startes og der skal anvendes sikker prævention under behandlingen og i 3 måneder efter seponering. Da det er ukendt, om nintedanib kan påvirke effekten af hormonelle kontraceptiva, tilrådes det at supplere med en barrieremetode.
Posterior reversibelt encefalopatisyndrom (PRES)
Der er rapporteret PRES, en neurologisk lidelse, med symptomer som hovedpine, hypertension, synsforstyrrelser, kramper, letargi, forvirring og synsforstyrrelser, med letalt udfald. Ved bekræftet PRES, skal behandling seponeres.
Hjælpestoffer
Kapslerne indeholder lecithin fra soja. Læs mere om soja og overfølsomhed.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Abdominalsmerter | Diarré*, Kvalme, Opkastning |
| Undersøgelser | Forhøjede leverenzymer | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Blødningstendens (oftest ikke-alvorlig epistaxis) | |
| Undersøgelser | Forhøjet basisk fosfatase, Vægttab | |
| Metabolisme og ernæring | Nedsat appetit | |
| Nervesystemet | Hovedpine | |
| Hud og subkutane væv | Hududslæt | |
| Vaskulære sygdomme | Hypertension | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Trombocytopeni | |
| Hjerte | Myokardieinfarkt | |
| Mave-tarm-kanalen | Colitis, Pancreatitis | |
| Lever og galdeveje | Leverskade | |
| Undersøgelser | Forhøjet bilirubin | |
| Metabolisme og ernæring | Dehydrering | |
| Nyrer og urinveje | Nyresvigt (tilfælde med dødelig udgang er set) | Proteinuri |
| Hud og subkutane væv | Alopeci | Hudkløe |
| Ikke kendt hyppighed | ||
| Lever og galdeveje | Hepatotoksicitet | |
| Nervesystemet | Posterior reversibelt encefalopati-syndrom | |
* Alvorlig diarré med dehydrering og elektrolytforstyrrelser er forekommet.
Kliniske aspekter
- De hyppigste bivirkninger ved nintedanib er: Diarre, nedsat appetit, madlede, kvalme, anoreksi, og vægttab.
- Opkastninger, hypertension og forhøjede leverenzymer forekommer sjældnere.
- Lav BMI og lav Performance Status ser ud til at disponere for de gastro-intestinale bivirkninger, mens alder ikke er en risikofaktor. Særligt lavt BMI er i et studie set øge risikoen for diarré (6227).
- De fleste tilfælde af diarre er milde-moderate, men enkelte patienter får intolerabel diarre, med behov for dosisreduktion eller evt. seponering.
- Ved tegn på diarré bør der sikres tilstrækkelig hydrering og igangsættes behandling (fx med et peristaltikhæmmende middel som loperamid).
- Ved kvalme kan behandles med antiemetika. Fokus på kostvejledning og ernæringstilskud (proteindrik) ved vægttab.
- Ved ustabil iskæmisk hjertesygdom bør behandlingen genovervejes individuelt ud fra den kardiologiske risiko i forhold til risikoen ved ubehandlet IPF.
- Seponering bør overvejes ved tegn på udvikling af nefrotisk syndrom (proteinuri).
Interaktioner
Nintedanib er et P-glykoprotein substrat. Risiko for øget eller nedsat plasmakoncentration ved kombination med henholdsvis P-glykoproteinhæmmere (fx ciclosporin, diltiazem, erythromycin, ritonavir) eller P-glykoproteininduktorer (fx rifampicin).
Graviditet
Baggrund: Der er ingen humane data. Dyrestudier tyder på et væsentligt fosterskadeligt potentiale ved klinisk relevante doser.
Amning
Baggrund: Der er ingen humane data for udskillelse i modermælken. På grund af virkningsmekanismen frarådes amning.
Bloddonor
Alkohol
Alkohol og Ofev® påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Hæmmer tyrosinkinase og påvirker vækstfaktor-receptorerne FGFR (fibroblast growth factor receptor), PDGFR (platelet derived growth factor receptor) og VEGFR (vascular endothelial growth factor receptor).
Farmakokinetik
- Biotilgængelighed ca. 5 %. Absorptionen øges ca. 20 % ved samtidig fødeindtagelse.
- Maksimal plasmakoncentration efter 2-4 timer.
- Fordelingsvolumen 15 l/kg.
- Substrat for P-glykoprotein.
- Plasmahalveringstid 10-15 timer.
- Ca. 93 % udskilles med fæces.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| bløde kapsler | 25 mg |
Farve
|
|
| 100 mg |
Farve
Andre
|
||
| 150 mg |
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | bløde kapsler
25 mg
Ofev |
426484 |
60 stk. (unit-dose)
|
4.346,80 | 72,45 | 1.101,29 | |
| (BEGR) | bløde kapsler
100 mg
Ofev |
197927 |
60 stk. (blister)
|
16.958,45 | 282,64 | 1.074,07 | |
| (BEGR) | bløde kapsler
150 mg
Ofev |
484271 |
60 stk. (blister)
|
20.094,05 | 334,90 | 848,42 |
Foto og identifikation
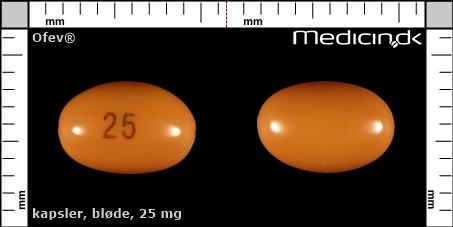
Bløde kapsler 25 mg |
| Præg: |
25
|
| Kærv: | Ikke relevant |
| Farve: | Orange |
| Mål i mm: | 8 x 5 |
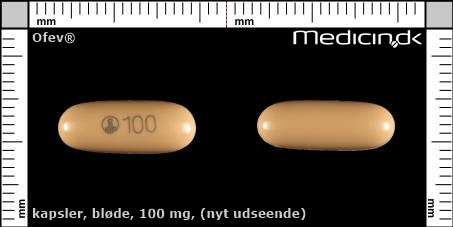
Bløde kapsler 100 mg (Nyt udseende) |
| Præg: |
100,
 |
| Kærv: | Ikke relevant |
| Farve: | Fersken |
| Mål i mm: | 6,2 x 16,1 |
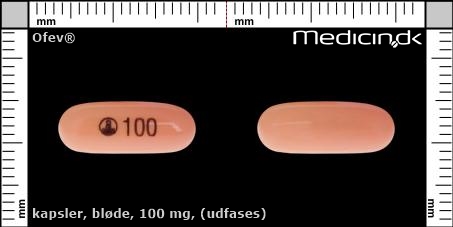
Bløde kapsler 100 mg (Udfases) |
| Præg: |
100,
 |
| Kærv: | Ikke relevant |
| Farve: | Fersken |
| Mål i mm: | 6,2 x 16,3 |
Bløde kapsler 150 mg (Nyt udseende) |
| Præg: |
150,
 |
| Kærv: | Ikke relevant |
| Farve: | Brun |
| Mål i mm: | 7 x 17,4 |

Bløde kapsler 150 mg (Udfases) |
| Præg: |
150,
 |
| Kærv: | Ikke relevant |
| Farve: | Brun |
| Mål i mm: | 7,1 x 17,6 |

Referencer
3800. pro.medicin.dk. 2025, https://pro.medicin.dk/ (Lokaliseret 5. maj 2025)
3801. Drugs.com. 2025, https://www.drugs.com/ (Lokaliseret 5. maj 2025)
6226. Deterding R, Young LR, DeBoer EM, Warburton D, Cunningham S, Schwerk N, Fla-herty KR, Brown KK, Dumistracel M, Erhardt E, Bertulis J, Gahlemann M, Stowasser S, Griese M. Nintedanib in children and adolescents with fibrosing interstitial lung diseases. Eur Respir J.. 2023; Feb 2;61(2):2201512, https://pubmed.ncbi.nlm.nih.gov/36041751/ (Lokaliseret 16. maj 2024)
6227. Kato M, Sasaki S, Nakamura T et al. Gastrointestinal adverse effects of nintedanib and the associated risk factors in patients with idiopathic pulmonary fibrosis. Sci Rep. 2019; 9(1), https://pubmed.ncbi.nlm.nih.gov/31427707/ (Lokaliseret 16. maj 2024)
3802. Micromedex. , https://www.micromedexsolutions.com (Lokaliseret 5. maj 2025)
3803. Produktresumeer. http://www.produktresume.dk, http://www.ema.europa.eu, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm, https://www.medicines.org.uk. , (Lokaliseret 5. maj 2025)



