Generel information
Anvendelsesområder
- Sygdomme og tilstande, hvor immunsuppression er indiceret.
Azathioprin bør kun anvendes, når behandlingen forestås af læger med særligt kendskab til immunsygdomme og deres behandling.
Dispenseringsform
Tabletter. 1 tablet (filmovertrukken) indeholder 25 mg eller 50 mg azathioprin.
Doseringsforslag
Transplantation
- Voksne og børn. Individuelt. Sædvanligvis 1-5 mg/kg legemsvægt/dag under nøje kontrol af leukocyt- og trombocyttal.
Kronisk aktiv hepatitis (autoimmun hepatitis)
- Voksne og børn. 1-2 mg/kg legemsvægt i døgnet.
Bemærk:
- Tabletterne synkes hele.
- Tages med et glas vand.
- Tabletterne må ikke knuses.
- Tablet kan opslæmmes i vand.
- Bør tages mindst 1 time før eller 2 timer efter indtagelse af mælk eller mælkeprodukter.
- Tages konsekvent med mad eller uden mad. Indtagelse sammen med mad nedsætter risikoen for bivirkninger i mave-tarm-kanalen.
- Hos ældre anbefales, at dosis ligger i den lavere ende af normaldoseringen.
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 25 mg, Aspen Nordic Ingen kærv |
| filmovertrukne tabletter 50 mg, Aspen Nordic Delekærven kan ikke anvendes til at dele tabletten |
| filmovertrukne tabletter 50 mg, Aspen Nordic (2care4) Delekærven kan ikke anvendes til at dele tabletten |
Mad og drikke
Tages med et glas vand.
Tages konsekvent med mad eller uden mad.
Bør tages mindst 1 time før eller 2 timer efter indtagelse af mælk eller mælkeprodukter.
Indtagelse sammen med mad nedsætter risikoen for bivirkninger i mave-tarm-kanalen.
Knusning/åbning
Må ikke knuses.
Administration
Synkes hele.
Tablet kan opslæmmes i vand.
Andet
Bemærk - personalerisiko: Ved håndtering af dette lægemiddel bør udvises forsigtighed.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Forsigtighed
GFR: 0-60 ml/min.
Patienter med nedsat nyrefunktion bør have en dosis, der ligger i den lavere ende af det normale doseringsinterval.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
Initialdosis bør evt. nedsættes, og tæt monitorering for bivirkninger tilrådes.
Seponering
Ophør med behandlingen bør altid ske som en gradvis nedtrapning under nøje monitorering.
Kontraindikationer
- Svær overfølsomhedsreaktion på mercaptopurin pga. risiko for krydsallergi.
- Samtidig behandling med febuxostat, se Interaktioner.
Forsigtighedsregler
- Blodbilledet kontrolleres hver uge de første 4 uger og derefter hver 4. måned, uanset dosis.
- Dosisreduktion ved knoglemarvsinsufficiens relateret til behandling.
- Infektion med varicella zoster virus (VZV, skoldkopper og herpes zoster) kan udvikle sig i alvorlig grad ved samtidig administration af flere immunosuppressiva. Forsigtighed bør udvises.
- Progressiv multifokal leukoencefalopati (PML), som er forårsaget af JC-virus, er blevet rapporteret hos patienter, der får azathioprin i kombination med andre immunsupprimerende midler. Immunsupprimerende behandling skal afbrydes ved de første objektive fund eller symptomer på PML, og tilstanden bør straks evalueres efter gældende guidelines.
- Øget risiko for reaktivering af HBV-infektion hos patienter med dokumenteret hepatitis B i anamnesen.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Blod og lymfesystem | Knoglemarvsdepression, Leukopeni | |
| Infektioner og parasitære sygdomme | Infektioner | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Trombocytopeni | |
| Mave-tarm-kanalen | Kvalme, Opkastning | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Anæmi | |
| Mave-tarm-kanalen | Pancreatitis, Steatoré | Diarré |
| Lever og galdeveje | Kolestase*, Leverpåvirkning (inkl. non-cirrotisk portal hypertension og portosinusoid vaskulær sygdom) | |
| Immunsystemet | Hypersensitivitetsreaktioner | |
| Hud og subkutane væv | Fotosensibilitet | |
| Sjældne (0,01-0,1 %) | ||
| Blod og lymfesystem | Agranulocytose, Aplastisk anæmi, Megaloblastisk anæmi, Myelodysplastisk syndrom, Pancytopeni | |
| Lever og galdeveje | Alvorlige hepatiske skader (livstruende) | |
| Benigne, maligne og uspecificerede neoplasmer | Cervixneoplasi, Hudcancer, Kaposis sarkom, Myeloid leukæmi, Neoplasmer, Sekundær malignitet | |
| Hud og subkutane væv | Alopeci | |
| Meget sjældne (< 0,01 %) | ||
| Mave-tarm-kanalen | Colitis, Diverticulitis, Gastro-intestinal blødning eller perforation | Diarré (svær diarré hos patienter med inflammatorisk tarmsygdom) |
| Immunsystemet | Stevens-Johnsons syndrom | |
| Luftveje, thorax og mediastinum | Interstitiel pneumonitis | |
| Hud og subkutane væv | Toksisk epidermal nekrolyse (TEN) | |
| Ikke kendt hyppighed | ||
| Blod og lymfesystem | Lymfom (hepatoplenisk T-celle lymfom) | |
| Metabolisme og ernæring | Pellagra** | |
| Hud og subkutane væv | Akut febril neutrofil dermatose | |
* Graviditetskolestase er lejlighedsvis blevet rapporteret i forbindelse med behandling med azathioprin.
** Ses især hos patienter med irritabel tarmsygdom IBD (Crohns sygdom, ulcerøs colitis).
Kliniske aspekter
- Ved brug af immundæmpende præparater er det velkendt, at der er øget risiko for infektioner.
- Langvarig behandling kan medføre en let øget cancer-risiko, især lymfeknude- og hudkræft.
Interaktioner
- Xanthinoxidasen er ansvarlig for hovedparten af den metaboliske inaktivering af 6-mercaptopurin:
- Samtidig behandling med febuxostat kan medføre en forstærket immunsuppressiv effekt, og kombinationen bør undgås. Er dette ikke muligt, bør dosis af azathioprin reduceres til højst 20 % af sædvanlig dosis.
- Samtidig behandling med allopurinol kan medføre en forstærket immunsuppressiv effekt, og dosis af azathioprin skal reduceres til ca. 25 % af sædvanlig dosis.
- Azathioprin har antagonistisk effekt over for ikke-depolariserende muskelrelakserende midler.
- Azathioprin kan forstærke effekten af depolariserende muskelrelakserende midler, fx suxamethon.
- Azathioprin kan hæmme effekten af warfarin og phenprocoumon.
- Kombinationen af azathioprin og mesalazin, balsalazid eller sulfasalazin kan øge risiko for myelosuppression.
- Infusion af infliximab kan i 1-3 uger herefter øge koncentrationen af azathioprins aktive metabolit.
- Reversibel levercellenekrose er påvist ved behandling med cyclophosphamid efter azathioprin.
- Der foreligger indberetninger om, at azathioprin påvirker effekten af intrauterine kontraceptiva. Det anbefales derfor at benytte anden eller supplerende antikonception.
- Hvis azathioprin kombineres med andre immunosuppressiva, fx ciclosporin eller tacrolimus, må den større risiko for udtalt immunsuppression tages i betragtning.
Der har været sygdomstilfælde, som tyder på, at hæmatologiske abnormaliteter kan udvikle sig som følge af samtidig indtagelse af azathioprin og ACE-hæmmere. - Vacciner med levende virus eller bakterier skal undgås under behandlingen og i mindst 3 måneder efter seponering.
Graviditet
Baggrund: Der er data for mere end 3.000 eksponerede gravide i løbet af graviditeten - de fleste heraf også i 1. trimester. De fleste data stammer fra nyretransplanterede patienter, men også i betydeligt omfang fra patienter med kronisk inflammatorisk tarmsygdom, som oftest har været i behandling med andre immunosuppressiva samtidigt, og det er i nogle datasæt ikke muligt at adskille specifik lægemiddeleksponering og outcome specielt for ciclosporin, tacrolimus og azathioprin. Der er overordnet ikke tegn på overhyppighed af medfødte misdannelser. Der synes overordnet at være en mindre overhyppighed af lav fødselsvægt og for tidlig fødsel. Confounding by indication er utvivlsomt et bias, som påvirker disse observationer.
Se også Klassifikation - graviditet
Fertile kvinder og mænd
Kvinder bør anvende sikker kontraception under og i 6 måneder efter behandlingsophør.
Mænd bør anvende sikker kontraception under og i 3 måneder efter behandlingsophør.
Amning
Baggrund: Azathioprin er et potent immunmodulerende lægemiddel, som kun i beskedent omfang udskilles i modermælken - den relative vægtjusterede dosis er under 1 %.
Der er omkring 500 (omend metodologisk meget heterogene) beskrevne observationer af ammede børn ved forskellige doser af azathioprin til moderen.
Overordnet set er der relativt få observationer iblandt disse, som tyder på påvirkninger af det ammede barn, og der synes ikke beskrevet alvorlige bivirkninger.
I nogle serier er der dog beskrevet påvirket blodbillede hos det ammede barn uden kliniske symptomer. Nogle har rapporteret en overhyppighed af infektioner, men disse data er mindre egnede til at vurdere kausalitet.
Såfremt man beslutter at behandle med azathioprin under amning, bør man have øget opmærksomhed på mulige bivirkninger hos det ammede barn, specielt infektioner.
Bloddonor
Ingen karantæne ved tapning af plasma til fraktionering.
Doping

|
Ingen restriktioner |
Alkohol
Forsigtighed ved indtag af alkohol under behandling med Imurel®.
Patienten kan opleve hypotension samt rejsningsbesvær.
Farmakodynamik
Azathioprin er en hypoxanthinanalog som efter aktivering først til 6-mercaptopurin og derefter til nukleotidet blokerer purinbiosyntesen.
Farmakokinetik
- Prodrug. Metaboliseres hurtigt efter absorption til den aktive metabolit, 6-mercaptopurin.
- Biotilgængeligheden af 6-mercaptopurin er ca. 60 % og nedsættes med ca. 25 % ved samtidig fødeindtagelse.
- Maksimal plasmakoncentration efter 1-2 timer.
- Plasmahalveringstid for 6-mercaptopurin ca. 1 time.
- 6-mercaptopurin oxideres til 6-tiourinsyre og andre metabolitter, der udskilles gennem nyrerne.
Egenskaber, håndtering og holdbarhed
Bemærk - personalerisiko: Azathioprin er muligvis kræftfremkaldende. Ved håndtering af dette præparat bør der tages passende forholdsregler. Brug altid handsker.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 25 mg |
Farve
Andre
|
|
| 50 mg |
Andre
|
||
| 50 mg (2care4) |
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (A) | filmovertrukne tabletter
25 mg
Imurel |
073947 |
50 stk. (blister)
|
116,35 | 2,33 | 13,96 | |
| (A) | filmovertrukne tabletter
50 mg
(2care4)
Imurel |
435648 |
50 stk. (blister)
|
108,60 | 2,17 | 6,52 | |
| (A) | filmovertrukne tabletter
50 mg
Imurel |
075009 |
100 stk. (blister)
|
232,05 | 2,32 | 6,96 | |
| (A) | filmovertrukne tabletter
50 mg
(2care4)
Imurel |
571964 |
100 stk. (blister)
|
173,70 | 1,74 | 5,21 |
Substitution
| filmovertrukne tabletter 25 mg |
|---|
| Azatioprin "Mylan" Viatris, Azathioprin, filmovertrukne tabletter 25 mg |
| filmovertrukne tabletter 50 mg |
|---|
| Azathioprin "Orifarm" Orifarm Generics, Azathioprin, filmovertrukne tabletter 50 mg |
| Azatioprin "Mylan" Viatris, Azathioprin, filmovertrukne tabletter 50 mg |
Foto og identifikation
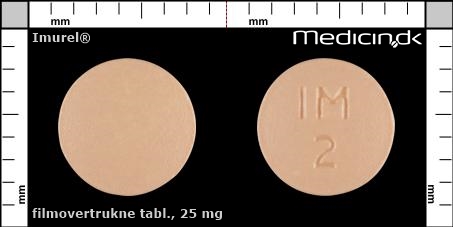
Filmovertrukne tabletter 25 mg |
| Præg: |
IM, 2
|
| Kærv: | Ingen kærv |
| Farve: | Orange |
| Mål i mm: | 6,1 x 6,1 |
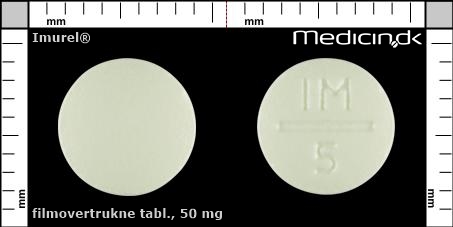
Filmovertrukne tabletter 50 mg |
| Præg: |
IM, 5
|
| Kærv: | Delekærven kan ikke anvendes til at dele tabletten |
| Farve: | Lysegul |
| Mål i mm: | 7,5 x 7,5 |
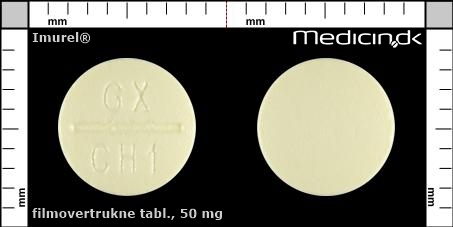
Filmovertrukne tabletter 50 mg (2care4) |
| Præg: |
GX, CH1
|
| Kærv: | Delekærven kan ikke anvendes til at dele tabletten |
| Farve: | Lysegul |
| Mål i mm: | 7 x 7 |
Referencer
5902. Reynolds JA, Gayed M, Khamashta MA et al. Outcomes of children born to mothers with systemic lupus erythematosus exposed to hydroxychloroquine or azathioprine. Rheumatology (Oxford). 2023; 62(3):1124-35, https://pubmed.ncbi.nlm.nih.gov/35766806/ (Lokaliseret 29. marts 2023)
3711. Janusinfo. Janusmed (Fosterpåverkan). Region Stochholm. 2021, https://janusmed.se/fosterpaverkan (Lokaliseret 22. februar 2022)
5900. Ikram N, Eudy A, Clowse MEB. Breastfeeding in women with rheumatic diseases. Lupus Sci Med. 2021; 8(1), https://pubmed.ncbi.nlm.nih.gov/33832977/ (Lokaliseret 29. marts 2023)
4277. Kamarajah SK, Arntdz K, Bundred J et al. Outcomes of Pregnancy in Recipients of Liver Transplants. Clin Gastroenterol Hepatol. 2018, https://www.ncbi.nlm.nih.gov/pubmed/30529735 (Lokaliseret 24. februar 2022)
4278. Colla L, Diena D, Rossetti M et al. Immunosuppression in pregnant women with renal disease: review of the latest evidence in the biologics era. J Nephrol. 2018; 31(3):361-83, https://www.ncbi.nlm.nih.gov/pubmed/29476421 (Lokaliseret 24. februar 2022)
4279. Sarkar M, Bramham K, Moritz MJ et al. Reproductive health in women following abdominal organ transplant. Am J Transplant. 2018; 18(5):1068-76, https://www.ncbi.nlm.nih.gov/pubmed/29446243 (Lokaliseret 24. februar 2022)
4285. Alami Z, Agier MS, Ahid S et al. Pregnancy outcome following in utero exposure to azathioprine: A French comparative observational study. Therapie. 2018; 73(3):199-207, https://www.ncbi.nlm.nih.gov/pubmed/29100610 (Lokaliseret 24. februar 2022)
4287. Garritsen FM, van den Broek MPH, van Zuilen AD et al. Pregnancy and fetal outcomes after paternal exposure to azathioprine, methotrexate or mycophenolic acid: a critically appraised topic. Br J Dermatol. 2017; 176(4):866-77, https://www.ncbi.nlm.nih.gov/pubmed/28418137 (Lokaliseret 24. februar 2022)
5901. Constantinescu S, Pai A, Coscia LA et al. Breast-feeding after transplantation. Best Pract Res Clin Obstet Gynaecol. 2014; 28(8):1163-73, https://pubmed.ncbi.nlm.nih.gov/25271063/ (Lokaliseret 29. marts 2023)
4281. Bramham K, Nelson-Piercy C, Gao H et al. Pregnancy in renal transplant recipients: a UK national cohort study. Clin J Am Soc Nephrol. 2013; 8(2):290-8, https://www.ncbi.nlm.nih.gov/pubmed/23085724 (Lokaliseret 24. februar 2022)
4286. Akbari M, Shah S, Velayos FS et al. Systematic review and meta-analysis on the effects of thiopurines on birth outcomes from female and male patients with inflammatory bowel disease. Inflamm Bowel Dis. 2013; 19(1):15-22, https://www.ncbi.nlm.nih.gov/pubmed/22434610 (Lokaliseret 24. februar 2022)
4288. Casanova MJ, Chaparro M, Domènech E et al. Safety of thiopurines and anti-TNF-α drugs during pregnancy in patients with inflammatory bowel disease. Am J Gastroenterol. 2013; 108(3):433-40, https://www.ncbi.nlm.nih.gov/pubmed/23318480 (Lokaliseret 24. februar 2022)
4280. Deshpande NA, James NT, Kucirka LM et al. Pregnancy outcomes of liver transplant recipients: a systematic review and meta-analysis. Liver Transpl. 2012; 18(6):621-9, https://www.ncbi.nlm.nih.gov/pubmed/22344967 (Lokaliseret 24. februar 2022)



