Generel information
Cytostatikum. Trifluridin (en thymidinanalog) i kombination med tiperacil (en thymidinfosforylasehæmmer).
Anvendelsesområder
- Metastatisk colorektal cancer, som tidligere er behandlet med, eller som ikke anses som egnet for anden tilgængelig behandling, herunder kemoterapi med fluoropyrimidin, oxaliplatin eller irinotecan samt anti-VEGF- og anti-EGFR-midler.
- Metastatisk colorektal cancer i kombination med bevacizumab, som har modtaget mindst to tidligere behandlinger, herunder fluorpyrimidin, oxaliplatin eller irinotecan, samt anti-VEGF- og/eller anti-EGFR-midler.
- Metastatisk gastrisk cancer, herunder adenokarcinom i den gastro-øsofageale overgang, efter mindst to tidligere behandlinger for fremskreden sygdom.
Trifluridin bør kun anvendes, når behandlingen forestås af læger med særligt kendskab til maligne lidelser og deres behandling.
Medicinrådet har lavet en vurdering af præparatet vedr. behandling af metastatisk colorektal cancer i kombination med bevacizumab.
Dispenseringsform
Tabletter.
1 tablet (filmovertrukken) indeholder
- 15 mg trifluridin og 6,14 mg tipiracil (som hydrochlorid)
- 20 mg trifluridin og 8,19 mg tipiracil (som hydrochlorid).
Doseringsforslag
Voksne. 35 mg/m2 legemsoverflade 2 gange dgl. på dag 1-5 og dag 8-12 i hver 28- dages cyklus.
Bemærk:
- Tabletterne synkes hele med et glas vand.
- Tabletterne må ikke knuses.
- Tages forskudt af et måltid. Tages inden for 1 time efter et måltid.
- Dosisreduktion kan være nødvendig pga. bivirkninger, især trombocytopeni, neutropeni og ikke-hæmatologiske bivirkninger (grad 4) se produktresumé.
Beregn overfladeareal og arealbestemt dosis her: Beregning af overfladeareal og arealbestemt dosis
Håndtering af kapsler og tabletter
| filmovertrukne tabletter 15 mg + 6,14 mg, Servier Danmark Ingen kærv |
| filmovertrukne tabletter 20 mg + 8,19 mg, Servier Danmark Ingen kærv |
Mad og drikke
Tages inden for 1 time efter et måltid.
Tages med et glas vand.
Tages forskudt af et måltid.
Knusning/åbning
Må ikke knuses.
Administration
Synkes hele.
Andet
Bemærk - personalerisiko: Ved håndtering af dette lægemiddel bør udvises forsigtighed.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Forsigtighed, erfaring savnes
GFR: 0-15 ml/min.
Erfaring savnes.
Dosisjustering
GFR: 15-30 ml/min.
Initialdosis 20 mg/m2 legemsoverflade 2 gange dgl. Dosisreduktion til minimum 15 mg/m2 legemsoverflade 2 gange dgl kan foretages, men herefter bør dosis ikke optrappes.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Forsigtighedsregler
Differentialtælling af blodceller foretages før behandlingsstart og derefter ved behov, men som minimum før hver behandlingscyklus.
Bivirkninger
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Blod og lymfesystem | Anæmi, Leukopeni, Neutropeni, Trombocytopeni | |
| Mave-tarm-kanalen | Diarré, Kvalme, Opkastning | |
| Almene symptomer og reaktioner på administrationsstedet | Træthed | |
| Metabolisme og ernæring | Nedsat appetit | |
| Almindelige (1-10 %) | ||
| Blod og lymfesystem | Lymfopeni | |
| Mave-tarm-kanalen | Abdominalsmerter, Stomatitis | Obstipation, Smagsforstyrrelser |
| Almene symptomer og reaktioner på administrationsstedet | Mucositis | Temperaturstigning, Utilpashed |
| Infektioner og parasitære sygdomme | Luftvejsinfektion | |
| Undersøgelser | Forhøjet ALAT/ASAT og basisk fosfatase, Forhøjet bilirubin, Vægttab | |
| Metabolisme og ernæring | Hypoalbuminæmi | |
| Nervesystemet | Perifer neuropati | |
| Nyrer og urinveje | Proteinuri | |
| Luftveje, thorax og mediastinum | Dyspnø | |
| Hud og subkutane væv | Alopeci, Palmar-plantar erytrodysæstesi | Hudkløe, Hududslæt, Tør hud |
| Vaskulære sygdomme | Ødemer | |
| Ikke almindelige (0,1-1 %) | ||
| Blod og lymfesystem | Monocytose, Pancytopeni | Leukocytose |
| Hjerte | Angina pectoris, Arytmier | Palpitationer |
| Øre og labyrint | Øregener | |
| Øjne | Conjunctivitis, Dobbeltsyn, Katarakt, Synsforstyrrelser | Øjentørhed |
| Mave-tarm-kanalen | Ascites, Colitis, Enterocolitis, Gastro-intestinal blødning, Ileus, Pancreatitis, Tandgener | Anal irritation, Dårlig ånde, Flatulens, Gastritis, Gastro-intestinale gener, Gastro-øsofageal refluks, Glossitis, Meteorisme, Mundhulegener (polypper), Proktalgi, Tandkødsbetændelse, Øsofagitis |
| Almene symptomer og reaktioner på administrationsstedet | Letargi | |
| Lever og galdeveje | Hepatotoksicitet | |
| Immunsystemet | Urticaria | |
| Infektioner og parasitære sygdomme | Herpes zoster, Infektioner | Fodsvamp, Influenzalignende symptomer |
| Traumer, forgiftninger og behandlingskomplikationer | Neurotoksicitet | Reaktioner og ubehag på indstiksstedet |
| Undersøgelser | Elektrolytforstyrrelser, Forhøjet serum-urat, Forlænget QT-interval, Nedsat hæmatokritværdi | Forhøjet plasma-kreatinin |
| Metabolisme og ernæring | Dehydrering, Hyperglykæmi | |
| Knogler, led, muskler og bindevæv | Artralgi, Knoglesmerter, Muskelkramper, Muskelsvaghed | Myalgi |
| Benigne, maligne og uspecificerede neoplasmer | Tumorsmerte | |
| Nervesystemet | Paræstesier, Svimmelhed | Hovedpine |
| Psykiske forstyrrelser | Angst | Søvnløshed |
| Nyrer og urinveje | Hæmaturi, Nyresvigt, Urinvejsinfektion, Vandladningsbesvær | Leukocyturi |
| Det reproduktive system og mammae | Menstruationsforstyrrelser | |
| Luftveje, thorax og mediastinum | Dysfoni, Pleuraekssudat | Epistaxis, Hoste, Orofaryngeale smerter, Rhinoré |
| Hud og subkutane væv | Erytem, Fotosensibilitet | Acne, Blister i huden, Hudafskalning, Negleforandringer, Øget svedtendens |
| Vaskulære sygdomme | Emboli, Hypertension, Hypotension, Septisk shock, Synkope | Ansigtsrødme |
Interaktioner
Samtidig brug af visse antivirale midler, fx zidovudin, kan medføre nedsat effekt af det antivirale middel, idet begge stoffer er substrat for human thymidinkinase. Skift til andet antiviralt lægemiddel, som ikke er substrat for human thymidinkinase, bør overvejes.
Graviditet
Baggrund: Der er ikke humane data som tillader et meningsfyldt risikoestimat. Prækliniske studier tyder på et teratogent potentiale. Enhver antineoplastisk behandling under graviditet vil være resultatet af en meget individuel og specifik vurdering af den underliggende sygdom, prognose, behandlingsalternativer og patientinvolvering. Der er ingen antineoplastiske lægemidler hvor der er kvantitative eller kvalitative humane data, som tillader et meningsfyldt risikoestimat. Generelt, på tværs af alle antineoplastiske lægemidler og de behandlede sygdomme, synes risikoen for medfødte misdannelser dog ikke væsentligt forøget. Såfremt der er behov for en detaljeret gennemgang af evidensen for det enkelte specifikke lægemiddel, anbefales kontakt til en Klinisk Farmakologisk Lægemiddelrådgivning.
Se også Antineoplastiske midler.
Se også Klassifikation - graviditet
Fertile kvinder og mænd
Kvinder i den fertile alder bør undgå at blive gravide, under og i 6 måneder efter endt behandling. Kvinder i den fertile alder skal bruge effektive præventionsmidler i samme periode.
Mænd, med en partner i den fødedygtige alder, skal anvende sikker kontraception under behandlingen og i op til 6 måneder efter seponering af behandlingen.
Amning
Bloddonor
Alkohol
Alkohol og Lonsurf påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
Trifluridin
- Odannes i kræftcellen til en aktiv form, der inkorporeres direkte i DNA, hvorved det påvirker DNAs funktion og dermed hæmmer celleproliferationen.
Tipiracil
- TPase-hæmmer, som derved hindrer kroppens TPase i at nedbryde trifluridin.
Farmakokinetik
- Mindst 57 % trifluridin hhv. 27 % tipiracil absorberes efter oral indgift.
- Maksimal plasmakoncentration efter 2 timer (trifluridin) hhv. 3 timer (tipiracil).
- Tipiracil øger AUC for trifluridin 37 gange og Cmax 22 gange i forhold til trifluridin alene.
- Plasmahalveringstid på 12.-dagen efter gentagne doser 2,1 time (trifluridin) hhv. 2,4 timer (tipiracil).
- Trifluridin udskilles overvejende gennem nyrerne, mens tipiracil overvejende udskilles fækalt.
Egenskaber, håndtering og holdbarhed
Bemærk - personalerisiko: Ved håndtering af Lonsurf bør udvises forsigtighed. Se endvidere Antineoplastiske midler.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| filmovertrukne tabletter | 15 mg + 6,14 mg |
Tipiracil (6,14 mg)
Trifluridin (15 mg)
|
Farve
Andre
|
| 20 mg + 8,19 mg |
Tipiracil (8,19 mg)
Trifluridin (20 mg)
|
Farve
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | filmovertrukne tabletter
15 mg + 6,14 mg
Lonsurf |
057979 |
20 stk. (blister)
|
7.967,30 | 398,37 | ||
| (BEGR) | filmovertrukne tabletter
15 mg + 6,14 mg
Lonsurf |
093926 |
20 stk. (blister) (Paranova)
|
Udgået 14-04-2025 | |||
| (BEGR) | filmovertrukne tabletter
15 mg + 6,14 mg
Lonsurf |
402146 |
20 stk. (blister) (Abacus)
|
7.967,30 | 398,37 | ||
| (BEGR) | filmovertrukne tabletter
20 mg + 8,19 mg
Lonsurf |
423283 |
20 stk. (blister) (Paranova)
|
Udgået 14-04-2025 | |||
| (BEGR) | filmovertrukne tabletter
20 mg + 8,19 mg
Lonsurf |
493119 |
20 stk. (blister) (Abacus)
|
10.615,85 | 530,79 | ||
| (BEGR) | filmovertrukne tabletter
20 mg + 8,19 mg
Lonsurf |
516182 |
20 stk. (blister)
|
10.615,85 | 530,79 | ||
| (BEGR) | filmovertrukne tabletter
15 mg + 6,14 mg
Lonsurf |
158698 |
60 stk. (blister)
|
23.848,05 | 397,47 | ||
| (BEGR) | filmovertrukne tabletter
20 mg + 8,19 mg
Lonsurf |
389330 |
60 stk. (blister)
|
31.793,55 | 529,89 |
Foto og identifikation
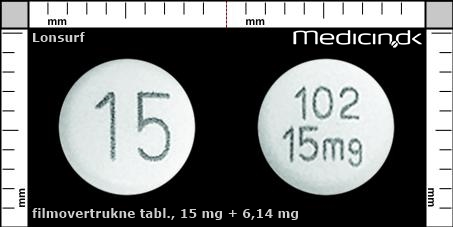
Filmovertrukne tabletter 15 mg + 6,14 mg |
| Præg: |
15 mg, 15, 102
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 7,1 x 7,1 |
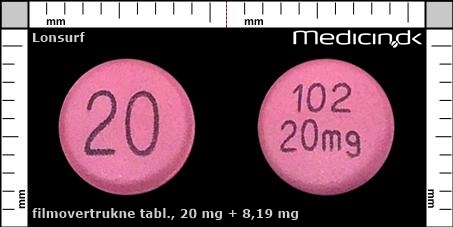
Filmovertrukne tabletter 20 mg + 8,19 mg |
| Præg: |
20 mg, 20, 102
|
| Kærv: | Ingen kærv |
| Farve: | Lyserød |
| Mål i mm: | 7,6 x 7,6 |
Referencer
4264. Danet C, Araujo M, Bos-Thompson MA et al. Pregnancy outcomes in women exposed to cancer chemotherapy. Pharmacoepidemiol Drug Saf. 2018; 27(12):1302-8, https://www.ncbi.nlm.nih.gov/pubmed/30379378 (Lokaliseret 24. februar 2022)
4388. de Haan J, Verheecke M, Van Calsteren K et al. Oncological management and obstetric and neonatal outcomes for women diagnosed with cancer during pregnancy: a 20-year international cohort study of 1170 patients. Lancet Oncol. 2018; 19(3):337-46, https://www.ncbi.nlm.nih.gov/pubmed/29395867 (Lokaliseret 3. marts 2022)
2954. Miyamoto S, Yamada M, Kasai Y et al. Anticancer drugs during pregnancy. Jpn J Clin Oncol. 2016; 46(9):795-804, https://www.ncbi.nlm.nih.gov/pubmed/27284093 (Lokaliseret 10. maj 2023)
2955. Esposito S, Tenconi R, Preti V et al. Chemotherapy against cancer during pregnancy: A systematic review on neonatal outcomes. Medicine (Baltimore). 2016; 95(38), https://www.ncbi.nlm.nih.gov/pubmed/27661036 (Lokaliseret 10. maj 2023)
4268. Loibl S, Schmidt A, Gentilini O et al. Breast Cancer Diagnosed During Pregnancy: Adapting Recent Advances in Breast Cancer Care for Pregnant Patients. JAMA Oncol. 2015; 8:1145-53, https://www.ncbi.nlm.nih.gov/pubmed/26247818 (Lokaliseret 24. februar 2022)
4270. Peccatori FA, Azim HA Jr, Orecchia R et al. Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013, https://www.ncbi.nlm.nih.gov/pubmed/23813932 (Lokaliseret 24. februar 2022)
4269. Loibl S, Han SN, von Minckwitz G et al. Treatment of breast cancer during pregnancy: an observational study. Lancet Oncol. 2012; 13(9):887-96, https://www.ncbi.nlm.nih.gov/pubmed/22902483 (Lokaliseret 24. februar 2022)
2789. Azim HA Jr, Peccatori FA, Pavlidis N. Treatment of the pregnant mother with cancer: a systematic review on the use of cytotoxic, endocrine, targeted agents and immunotherapy during pregnancy. Part I: Solid tumors. Cancer Treat Rev. 2010; 36(2):101-9, http://www.ncbi.nlm.nih.gov/pubmed/20015593 (Lokaliseret 4. maj 2023)
2790. Azim HA Jr, Pavlidis N, Peccatori FA. Treatment of the pregnant mother with cancer: a systematic review on the use of cytotoxic, endocrine, targeted agents and immunotherapy during pregnancy. Part II: Hematological tumors. Cancer Treat Rev. 2010; 36(2):110-21, http://www.ncbi.nlm.nih.gov/pubmed/20018452 (Lokaliseret 4. maj 2023)
691. Cardonick E, Iacobucci A. Use of chemotherapy during human pregnancy. Lancet Oncol. 2004; 5(5):283-91, https://pubmed.ncbi.nlm.nih.gov/15120665/ (Lokaliseret 7. december 2021)
4267. PDQ Adult Treatment Editorial Board. Breast Cancer Treatment During Pregnancy (PDQ®): Health Professional Version. PDQ Cancer Information Summaries, National Cancer Institute (US). 2002-2017, https://www.ncbi.nlm.nih.gov/pubmed/26389427 (Lokaliseret 24. februar 2022)
692. Arnon J, Meirow D, Lewis-Roness H et al. Genetic and teratogenic effects of cancer treatments on gametes and embryos. Hum Reprod Update. 2001; 7(4):394-403, https://pubmed.ncbi.nlm.nih.gov/11476352/ (Lokaliseret 7. december 2021)



