Generel information
Antineoplastisk middel. Proteinkinasehæmmer.
Anvendelsesområder
Anvendes til voksne med fremskreden gastro-intestinale bindevævstumor (GIST), som tidligere er behandlet med tre eller flere kinasehæmmere, herunder imatinib.
Bør kun anvendes, når behandlingen forestås af læger med særligt kendskab til maligne lidelser og deres behandling.
Dispenseringsform
Tabletter. 1 tablet indeholder 50 mg ripretinib.
Doseringsforslag
- Voksne. 150 mg 1 gang dgl.
- Ved behov for dosisreduktion pga. bivirkninger anbefales 100 mg 1 gang dgl, se produktresumé for detaljer, inklusive pausering og seponering.
Kombination med CYP3A4-induktorer
Samtidig behandling med moderate eller stærke induktorer af CYP3A4 anbefales normalt ikke. Hvis samtidig behandling med en potent CYP3A4-induktor er nødvendig, kan dosisfrekvensen af ripretinib øges til 150 mg 2 gange dgl. Tæt monitorering af effekt og bivirkninger anbefales. Se i øvrigt Interaktioner.
Glemt medicin
- 150 mg 1 gang dgl.: Glemt dosis kan tages inden for 8 timer. Hvis der er gået mere end 8 timer springes dosis over, og den næste dosis tages som planlagt.
- 150 mg 2 gange dgl.: Glemt dosis kan tages inden for 4 timer. Hvis der er gået mere end 4 timer springes dosis over, og den næste dosis tages som planlagt.
Håndtering af kapsler og tabletter
| tabletter 50 mg, Deciphera Ingen kærv |
Knusning/åbning
Må ikke knuses.
Administration
Synkes hele med et glas vand.
Må ikke tygges.
Andet
Bemærk - personalerisiko: Ved håndtering af dette lægemiddel bør udvises forsigtighed.
Se endvidere Håndtering af tabletter og kapsler.
Nedsat nyrefunktion
Forsigtighed, ingen eller begrænset erfaring
GFR: 0-30 ml/min.
Dosisanbefaling kan ikke gives ved svært nedsat nyrefunktion pga. begrænset mængde kliniske data.
Beregn eGFR for patienter > 17 år: Beregning af eGFR ud fra CKD-EPI–formlen
Nedsat leverfunktion
Erfaring savnes vedr. stærkt nedsat leverfunktion (Child-Pugh C).
Tæt monitorering af patienten anbefales.
Forsigtighedsregler
Monitorering
- Der er indberettet hypertension ved behandling med ripretinib. Behandlingen må ikke påbegyndes, medmindre blodtrykket er tilstrækkeligt kontrolleret. Blodtrykket skal monitoreres som klinisk angivet.
- Der er observeret hjerteinsufficiens ved behandlingen. Uddrivningsfraktionen bør vurderes med ekkokardiogram eller Multigated Acquisition Scan (MUGA) scanning før og under behandlingen, hvis klinisk indiceret. Behandlingen bør seponeres ved grad 3 eller 4 systolisk dysfunktion i venstre ventrikel.
- Kutane maligniteter er forekommet under behandlingen, og derfor bør der udføres dermatologiske undersøgelser udføres ved start og regelmæssigt under behandlingen. Mistænkelige hudlæsioner skal fjernes og undersøges.
Fototoksicitet
- Pga. risiko for fototoksicitet bør patienter i behandling med ripretinib undgå udsættelse for stærkt sollys og UV-lys.
Sårheling
- På grund af risiko for utilstrækkelig sårheling anbefales pausering af behandlingen mindst 3 dage før og efter mindre operationer, og mindst 5 dage før og efter større operationer.
Bivirkninger
Dette lægemiddel har skærpet indberetningspligt. Alle eventuelle bivirkninger ved brugen skal derfor indberettes til Lægemiddelstyrelsen, se Lægemiddelstyrelsen (Meld en bivirkning).
Registrerede bivirkninger |
||
| Systemorganklasse | Potentielt alvorlige bivirkninger | Oftest ikke alvorlige bivirkninger |
| Meget almindelige (> 10 %) | ||
| Mave-tarm-kanalen | Diarré, Kvalme, Obstipation, Opkastning | |
| Almene symptomer og reaktioner på administrationsstedet | Træthed | |
| Undersøgelser | Forhøjet bilirubin, Forhøjet plasma-lipase, Vægttab | |
| Metabolisme og ernæring | Hypofosfatæmi | |
| Knogler, led, muskler og bindevæv | Artralgi, Muskelspasmer, Rygsmerter | Myalgi |
| Nervesystemet | Hovedpine | |
| Luftveje, thorax og mediastinum | Dyspnø | |
| Hud og subkutane væv | Alopeci, Palmar-plantar erytrodysæstesi** | Hudkløe, Tør hud |
| Vaskulære sygdomme | Hypertension, Perifere ødemer | |
| Almindelige (1-10 %) | ||
| Hjerte | Hjerteinsufficiens | Takykardi |
| Det endokrine system | Hypotyroidisme | |
| Mave-tarm-kanalen | Abdominalsmerter*, Stomatitis | |
| Undersøgelser | Forhøjet ALAT | |
| Knogler, led, muskler og bindevæv | Muskelsvaghed | |
| Benigne, maligne og uspecificerede neoplasmer | Spinocellulært karcinom | |
| Nervesystemet | Neurolæsioner | |
| Psykiske forstyrrelser | Depression | |
| Luftveje, thorax og mediastinum | Hoste | |
| Hud og subkutane væv | Acnelignende hududslæt, Hyperkeratoser, Makulopapuløst hududslæt | |
| Ikke almindelige (0,1-1 %) | ||
| Benigne, maligne og uspecificerede neoplasmer | Malignt melanom | |
* Smerte i den øvre del af maven.
** Kan være nødvendigt at pausere, dosisjustere eller seponere behandlingen.
Interaktioner
- Potente CYP3A4-hæmmere, fx ketoconazol, erythromycin, clarithromycin, itraconazol, ritonavir og voriconazol øger plasmakoncentrationen af ripretinib og samtidig administration bør derfor undgås.
- Potente CYP3A4-inducerende midler, fx carbamazepin, rifampicin, phenobarbital og naturlægemidler med perikon, eller moderate CYP3A4-inducerende midler nedsætter AUC for ripretinib og samtidig administration bør undgås.
- Der er risiko for interaktioner med CYP1A2-, CYP2B6-, CYP2C8-, CYP3A4-, og P-gp-substrater med snævert terapeutisk vindue (fx tizanidin, efavirenz, repaglinid, paclitaxel, ciclosporin, tacrolimus, dabigatranetexilat og digoxin).
- Se endvidere Tabel 2 i Elimination og cytokrom P450-systemet.
Graviditet
Baggrund: Der er ikke humane data som tillader et meningsfyldt risikoestimat. Prækliniske studier tyder på et teratogent potentiale.
Enhver antineoplastisk behandling under graviditet vil være resultatet af en meget individuel og specifik vurdering af den underliggende sygdom, prognose, behandlingsalternativer og patientinvolvering. Der er ingen antineoplastiske lægemidler hvor der er kvantitative eller kvalitative humane data, som tillader et meningsfyldt risikoestimat. Generelt, på tværs af alle antineoplastiske lægemidler og de behandlede sygdomme, synes risikoen for medfødte misdannelser dog ikke væsentligt forøget. Hvis der er behov for en detaljeret gennemgang af evidensen for det enkelte specifikke lægemiddel, anbefales kontakt til en Klinisk Farmakologisk Lægemiddelrådgivning.
Se også Antineoplastiske midler.
Se også Klassifikation - graviditet
Fertile kvinder og mænd
Der skal foreligge negativ graviditetstest før initiering af behandling. Der tilrådes sikker kontraception under og i mindst en uge efter behandlingsophør.
Amning
Baggrund: På grund af virkningsmekanismen frarådes amning.
Bloddonor
Alkohol
Alkohol og QINLOCK® påvirker ikke hinanden.
Følg dog altid Sundhedsstyrelsens anbefalinger om genstandsgrænser.
Farmakodynamik
- Hæmmer C-KIT, en tyrosinkinase, som er overaktiveret ved GIST-tumorer.
- Hæmmer desuden PDGFRA-kinase, PDGFB, TIE2, VEGFR2 og BRAF.
Farmakokinetik
- Steady-state opnås inden for 14 dage.
- Cmax opnås 4 timer efter en enkeltdosis på 150 mg oralt.
- Fordelingsvolumen 4,3 l/kg for ripretinib og 7,0 l/kg for DP-5439.
- Metaboliseres i leveren. Primært via CYP3A4/5 til den aktive metabolit DP-5439 og i mindre grad via CYP2C8 og CYP2D6.
- Halveringstiden ca. 12,6 timer for ripretinib og 15,6 timer for DP-5439.
Indholds- og hjælpestoffer
| Lægemiddelform | Styrke | Indholdsstoffer | Udvalgte hjælpestoffer |
|---|---|---|---|
| tabletter | 50 mg |
Andre
|
Firma
Pakninger, priser, tilskud og udlevering
| Tilskud | Udlevering | Disp.form og styrke | Vnr. | Pakning | Pris | Pris enh. | Pris DDD. |
|---|---|---|---|---|---|---|---|
| (BEGR) | tabletter
50 mg
QINLOCK |
517231 |
90 stk.
|
177.173,15 | 1.968,59 | 5.905,77 |
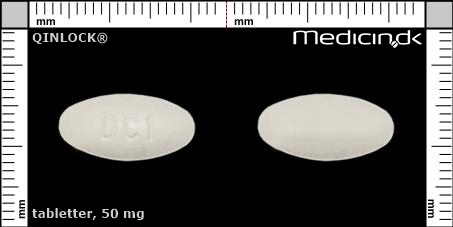
Foto og identifikation
Tabletter 50 mg |
| Præg: |
DC1
|
| Kærv: | Ingen kærv |
| Farve: | Hvid |
| Mål i mm: | 17 x 9 |
Referencer
4264. Danet C, Araujo M, Bos-Thompson MA et al. Pregnancy outcomes in women exposed to cancer chemotherapy. Pharmacoepidemiol Drug Saf. 2018; 27(12):1302-8, https://www.ncbi.nlm.nih.gov/pubmed/30379378 (Lokaliseret 24. februar 2022)
4388. de Haan J, Verheecke M, Van Calsteren K et al. Oncological management and obstetric and neonatal outcomes for women diagnosed with cancer during pregnancy: a 20-year international cohort study of 1170 patients. Lancet Oncol. 2018; 19(3):337-46, https://www.ncbi.nlm.nih.gov/pubmed/29395867 (Lokaliseret 3. marts 2022)
2954. Miyamoto S, Yamada M, Kasai Y et al. Anticancer drugs during pregnancy. Jpn J Clin Oncol. 2016; 46(9):795-804, https://www.ncbi.nlm.nih.gov/pubmed/27284093 (Lokaliseret 10. maj 2023)
2955. Esposito S, Tenconi R, Preti V et al. Chemotherapy against cancer during pregnancy: A systematic review on neonatal outcomes. Medicine (Baltimore). 2016; 95(38), https://www.ncbi.nlm.nih.gov/pubmed/27661036 (Lokaliseret 10. maj 2023)
4268. Loibl S, Schmidt A, Gentilini O et al. Breast Cancer Diagnosed During Pregnancy: Adapting Recent Advances in Breast Cancer Care for Pregnant Patients. JAMA Oncol. 2015; 8:1145-53, https://www.ncbi.nlm.nih.gov/pubmed/26247818 (Lokaliseret 24. februar 2022)
4270. Peccatori FA, Azim HA Jr, Orecchia R et al. Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013, https://www.ncbi.nlm.nih.gov/pubmed/23813932 (Lokaliseret 24. februar 2022)
4269. Loibl S, Han SN, von Minckwitz G et al. Treatment of breast cancer during pregnancy: an observational study. Lancet Oncol. 2012; 13(9):887-96, https://www.ncbi.nlm.nih.gov/pubmed/22902483 (Lokaliseret 24. februar 2022)
2789. Azim HA Jr, Peccatori FA, Pavlidis N. Treatment of the pregnant mother with cancer: a systematic review on the use of cytotoxic, endocrine, targeted agents and immunotherapy during pregnancy. Part I: Solid tumors. Cancer Treat Rev. 2010; 36(2):101-9, http://www.ncbi.nlm.nih.gov/pubmed/20015593 (Lokaliseret 4. maj 2023)
2790. Azim HA Jr, Pavlidis N, Peccatori FA. Treatment of the pregnant mother with cancer: a systematic review on the use of cytotoxic, endocrine, targeted agents and immunotherapy during pregnancy. Part II: Hematological tumors. Cancer Treat Rev. 2010; 36(2):110-21, http://www.ncbi.nlm.nih.gov/pubmed/20018452 (Lokaliseret 4. maj 2023)
691. Cardonick E, Iacobucci A. Use of chemotherapy during human pregnancy. Lancet Oncol. 2004; 5(5):283-91, https://pubmed.ncbi.nlm.nih.gov/15120665/ (Lokaliseret 7. december 2021)
4267. PDQ Adult Treatment Editorial Board. Breast Cancer Treatment During Pregnancy (PDQ®): Health Professional Version. PDQ Cancer Information Summaries, National Cancer Institute (US). 2002-2017, https://www.ncbi.nlm.nih.gov/pubmed/26389427 (Lokaliseret 24. februar 2022)
692. Arnon J, Meirow D, Lewis-Roness H et al. Genetic and teratogenic effects of cancer treatments on gametes and embryos. Hum Reprod Update. 2001; 7(4):394-403, https://pubmed.ncbi.nlm.nih.gov/11476352/ (Lokaliseret 7. december 2021)



